Химические реакции с алюминием. Реакции алюминия с водородом и другими веществами
Часть I
1. Дополните схему строения атома алюминия.
13Al 2е, 8е, 3е или
2. Al проявляет сильные восстановительные свойства, получая при этом с.о. +3, по соответствующей схеме:
![]()
3. Эта же схема отражает образование в простом веществе металлической связи.
Алюминий имеет металлическую кристаллическую решётку и характеризуется следующими физическими свойствами: серебристо-белый, электро-, термопроводен, пластичный.
4. Заполните таблицу «Применение алюминия на основе его физических свойств».

5. В ряду активности металлов алюминий следует за металлами IIA группы, т.е. очень активен, но с водой, как подсказывает бытовой опыт, не взаимодействует при обычных условиях (алюминиевые провода и посуда не разрушаются под действием воды). Почему?
Есть защитная плёнка оксида алюминия.
Как осуществить реакцию, схема которой:
Al+H2O→Al(OH)3+H2 ?
Растереть алюминий в порошок и смешать с водой при высокой температуре.
6. Химические свойства алюминия (запишите уравнения возможных реакций – молекулярные, полные и сокращённые ионные).
1) Сгорает при нагревании (рассмотрите с позиций окисления-восстановления).

2) Взаимодействует с неметаллами (рассмотрите ОВР).

3) Взаимодействует с растворами кислот.

4) Взаимодействует с растворами солей.
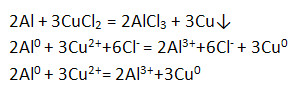
5) Взаимодействует с оксидами металлов – алюминотермия.
![]()
6) Взаимодействует с растворами щелочей.

Часть II
1. Заполните таблицу «Применение алюминия на основе его химических свойств».

2. Запишите уравнения реакций, с помощью которых можно осуществить соответствующие переходы, в свете ОВР.

3. Амальгама – это соединение, в состав которого входит ртуть.
В химии алюминия она играет важную роль - как восстанавливающий агент в органических синтезах.
4. Подготовьте сообщение об амальгамах золота и их значении, используя различные источники информации(интернет). Запишите тезисы сообщения или составьте его план в особой тетради.
Метод амальгамации основан на способности ртути образовывать сплавы - амальгамы с различными металлами, в том числе и с золотом. В этом методе увлажненная дробленая порода смешивалась со ртутью и подвергалась дополнительному измельчению в мельницах-чашах. Амальгаму золота (и сопутствующих металлов) извлекали промывкой, после чего ртуть отгонялась из собранной амальгамы и использовалась повторно. Метод амальгамации известен с I века до н. э., наибольшие масштабы приобрел в американских колониях Испании начиная с XVI века. Это стало возможным благодаря наличию в Испании огромного ртутного месторождения - Альмаден. В более позднее время использовался метод внешней амальгамации, когда дробленая золотоносная порода при промывке пропускалась через обогатительные шлюзы, выстланные медными листами, покрытыми тонким слоем ртути. Метод амальгамации применим только на месторождениях с высоким содержанием золота или уже при его обогащении. Сейчас он используется очень редко, главным образом старателями в Африке и Южной Америке.
5. Подготовьте с помощью Интернета презентацию (5-10 слайдов) на тему «История алюминия». Запишите план презентации.
1) Открытие алюминия
2) Нахождение в природе
3) Физические и химические свойства
4) Получение
5) Применение
6. Вычислите, какое количество граммов оксида хрома (III), содержащего 20% примесей, и моль алюминия необходимо для получения 4,5 моль хрома с помощью алюминотермии.
Химический элемент алюминий – лёгкий металл серебристого цвета. Алюминий - самый распространенный в земной коре металл. Физические и химические свойства алюминия позволили ему найти широкое применение в современной промышленности и повседневной жизни.
Химические свойства алюминия

Химическая формула алюминия Аl. Атомный номер 13. Алюминий относится к простым веществам, так как его молекула содержит атом только одного элемента. Внешний энергетический уровень атома алюминия содержит 3 электрона. Эти электроны легко отдаются атомом алюминия во время химических реакций. Поэтому алюминий имеет высокую химическую активность и способен вытеснять металлы из их оксидов. Но в обычных условиях он довольно устойчив к химическому взаимодействию, так как покрыт прочной оксидной плёнкой.
С кислородом алюминий взаимодействует только при высокой температуре. В результате реакции образуется оксид алюминия. С серой, фосфором, азотом, углеродом взаимодействие также происходит при высокой температуре. А вот с хлором и бромом алюминий вступает в реакцию при обычных условиях. С йодом реагирует при нагревании, но только если катализатором выступает вода. С водородом алюминий не взаимодействует.
С металлами алюминий способен образовывать соединения, которые называются алюминиды.
В реакцию с водой вступает алюминий, очищенный от оксидной плёнки. Гидроксид, который получается в результате этой реакции, является малорастворимым соединением.
Алюминий легко взаимодействует с разбавленными кислотами, образуя соли. Но с концентрированными кислотами реагирует только при нагревании, образуя соли и продукты восстановления кислоты.
Алюминий легко реагирует со щелочами.
Физические свойства алюминия

Алюминий - прочный металл, но в то же время и пластичный, легко подвергается механической обработке: штамповке, полировке, вытягиванию.
Алюминий самый легкий из металлов. Имеет очень высокую теплопроводность. По электропроводности алюминий практически не уступает меди, но при этом он намного легче и дешевле.
Применение алюминия

Впервые металл алюминий был получен датским физиком Гансом Христианом Эрстедом в 1825 г . И в те времена алюминий считали драгоценным металлом. Модницы любили носить украшения из него.
Но промышленный способ получения алюминия был создан значительно позже - в 1855 г. французским химиком Анри Этьенн Сент-Клер Девилем.
Алюминиевые сплавы применяются практически во всех машиностроительных отраслях. Современная авиационная, космическая и автомобильная промышленность, кораблестроение не могут обходиться без таких сплавов. Наиболее известные сплавы – дюралюминий, силумин, литейные сплавы. Пожалуй, самым востребованным из этих сплавов является дюралюминий.
При переработке алюминия горячей и холодной обработкой получают профили, проволоку, трубы, ленты, листы. Алюминиевые листы или лента широко используются в современном строительстве. Так, специальную алюминиевую ленту применяют для заклеивания торцов различных строительных панелей, чтобы обеспечить надежную защиту от попадания осадков и пыли внутрь панели.
Так как алюминий обладает высокой электропроводностью, его используют для изготовления электропроводов и электротехнических шин.
Алюминий не является драгоценным металлом. Но некоторые его соединения используются в ювелирной промышленности. Наверное, не все знают, что рубин и сапфир – это монокристаллы окиси алюминия, в которые добавлены красящие окислы. Красный цвет рубину придают ионы хрома, а голубой цвет сапфира – от содержания ионов железа и титана. Чистая кристаллическая окись алюминия называется корундом.
В промышленных условиях создают искусственные корунд, рубин и сапфир.
Используется алюминий и в медицине. Он входит в состав некоторых препаратов, которые оказывают адсорбирующее, обволакивающее и обезболивающее действие.
Трудно найти такую отрасль современной промышленности, в которой не использовались бы алюминий и его соединения.
Характер взаимодействия металлов с газами в условиях сварки во многом определяет природу пор.
Алюминий обладает большим сродством к кислороду. Растворимость кислорода в жидком алюминии ничтожно мала (не более 0,0003%) и характерным для процесса взаимодействия алюминия и его сплавов с кислородом является образование оксидов. Оксид алюминия образует несколько кристаллический модификаций, существование которых и переход одной в другую определяется температурой, временем выдержки и составом окружающей среды.
Скорость протекания диффузионных процессов и химических реакций, определяющих кинетический закон окисления, в данном случае соизмеримы.
Следует отметить, что температура, при которой начинается интенсивное химическое взаимодействие металлов с парами воды, тем ниже, чем больше развита поверхность металла. Термическая прочность оксида Al 2 O 3 чрезвычайно велика. Некоторые свойства оксида: температура плавления 2310-2320 К; температура кипения 2500-3800 К; плотность при температуре плавления 3,01 г/см 3 , в жидком состоянии – 2,5 г/см 3 ; теплота плавления 110 кДж/моль, теплота испарения 485 кДж/моль; плотность при 20˚С 3,96 г/см 3 ; плотность плёнки (отношение молекулярного объёма плёнки к атомному объёму металла) 1,25; коэффициент расширения 6,58×10 -6 К -1 ; электросопротивление 1×10 7 Ом/см.
Окисление алюминия протекает с большой скоростью при ничтожно малом парциальном давлении кислорода или кислородосодержащих сложных газов и с повышением температуры ещё более возрастает.
На начальном этапе окисления алюминия формируется компактная аморфная плёнка Al 2 O 3 барьерного типа, не проницаемая для окружающего воздуха. Дальнейший рост оксидной плёнки возможен в результате взаимной диффузии катионов металла и анионов кислорода через слой образовавшегося оксида. Диффузионный этап роста оксида носит эндотермический характер, т.е. является термоактивируемым процессом.
На практике окисление алюминия происходит в присутствии влаги, содержание которой в воздухе доходит до 4%. В этих условиях на поверхность алюминия в первую очередь адсорбируются молекулы воды, так как, в отличие от неполярных молекул азота, кислорода и водорода, они являются диполями, обладающими значительно большей адсорбционной способностью.
После физической адсорбции, характеризующейся слабым взаимодействием сил Ван-дер-Ваальса, начинается вторая стадия – хемосорбция:
2Al + 3Н 2 О → 6Н + Al 2 O 3
Выделяющийся атомарный водород легко диффундирует в плёнку и решётку
алюминия, где часто ионизируется. Образующаяся оксидная плёнка обладает высокой адсорбирующей способностью и адсорбирует на свою поверхность влагу, кислород и другие газы. Далее кислород диссоциирует на атомы,
проникает в неупорядоченную структуру плёнки и может образовывать с
метастабильной фазой Al 2 O 3 и водородом моногидоксид AlOOH, который в дальнейшем превращается в тригидроксид Al(OH) 3 .
Таким образом, при окислении при температуре 18-20˚С в атмосфере воздуха, содержащего влагу, формируются тонкие оксидные плёнки защитного типа, имеющие сложный состав Al 2 O 3 → AlOOH → Al(OH) 3 .
Дальнейшее окисление алюминия и рост оксидной плёнки возможны при повышенных температурах в результате диффузии катионов металла через плёнку к поверхности газ-оксид и, наоборот, диффузии анионов к границе оксидная плёнка-металл.
Скорость увеличения толщины оксидной плёнки возрастает с повышением температуры, а переход металла из твёрдого состояния в жидкое не вызывает изменения в этой тенденции. Поскольку кинетику окисления определяет диффузия катионов парциальное давление кислорода не должно существенно влиять на этот процесс.
На состав, структуру и, в целом, на механизм и кинетику окисления алюминия влияют легирующие элементы в его сплавах и примеси металлов. В качестве основных легирующих элементов в сплавах присутствуют медь, магний, марганец, кремний, цинк, литий. В ряде сплавов в небольших количествах вводят добавки титана, бериллия, хрома, никеля, кадмия, скандия и др. Суммарное содержание легирующих элементов в деформируемых сплавах алюминия обычно не превышает 10%.
Такие элементы как магний, бериллий, литий вследствие более высоких, чем у алюминия, отрицательных энергий образования оксидов могут окисляться в сплавах алюминия даже при очень малом содержании. Литий, натрий, магний в жидком алюминии играют роль поверхностно-активных элементов. Их концентрация в поверхностном слое выше средней концентрации в расплаве.
Свойства оксидной плёнки на алюминии, которые имеют большое значение в
определении природы и механизма образования пор при сварке:
1. Оксидная плёнка алюминия отличается высокими защитными свойствами и на определённом этапе окисления может предотвратить дальнейшее взаимодействие алюминия с газами.
2. Оксид алюминия имеет высокую температуру плавления и в условиях сварки не расплавляется. В связи с этим поверхностная плёнка сохраняется как внутри объёма сварочной ванны (плёнка, попавшая в ванну с обратной стороны кромок и их торцовых поверхностей), так и на её поверхности (плёнка внешней стороны свариваемых кромок), несмотря на большую плотность, чем плотность жидкого алюминия. В последнем случае плёнка удерживается на поверхности ванны силами поверхностного натяжения.
3. Оксид алюминия не растворяется ни в твёрдом, ни в жидком металле. Плёнка также отличается высокой механической прочностью.
4. Наличие в сплавах алюминия таких легирующих элементов как литий и магний, делают оксидную плёнку на алюминии более адсорбционно-способной и усиливает её роль потенциального источника газов.
5. Важным свойством оксидной плёнки на алюминии является её высокая адсорбционная способность к парам воды. Водяной пар, адсорбированный окисленной поверхностью алюминия, удерживается до высоких температур. Часть влаги имеющейся на поверхности алюминия сохраняется даже после выдержки металла в вакууме при температуре до 350˚С. Оставшаяся часть, очевидно, связанная в виде гидрата и находящаяся в глубоких микротрещинах на оксидной плёнке, удаляется при более высоких температурах и может реагировать с металлом с образованием водорода. Гидрат оксида алюминия удерживает некоторое количество воды вплоть до




