Kemialliset reaktiot alumiinin kanssa. Alumiinin reaktiot vedyn ja muiden aineiden kanssa
Osa I
1. Täytä alumiiniatomin rakenne.
13Al 2e, 8e, 3e tai
2. Al: lla on vahvoja pelkistäviä ominaisuuksia, kun se samalla saadaan. +3 vastaavan kaavion mukaan:
![]()
3. Sama kuvio heijastaa metallisidoksen muodostumista yksinkertaisessa aineessa.
Alumiinissa on metalli kidehila ja jolle on tunnusomaista seuraava fysikaaliset ominaisuudet: hopeavalkoinen, sähkö, lämpöä johtava, pallografiitti.
4. Täytä taulukko ”Alumiinin käyttö fysikaalisten ominaisuuksiensa perusteella”.

5. Sarjassa metalliaktiivisuutta alumiini seuraa ryhmän IIA metalleja, ts. erittäin aktiivinen, mutta veden kanssa, kuten kotitalouskokemus osoittaa, ei ole vuorovaikutuksessa normaalit olosuhteet (vesi ei tuhoa alumiinijohtimia ja astioita). Miksi?
Alumiinioksidista on suojakalvo.
Kuinka suorittaa reaktio, jonka kaavio:
Al + H20 → Al (OH) 3 + H2?
Hioma alumiini jauheeksi ja sekoitetaan veden kanssa korkeassa lämpötilassa.
6. Alumiinin kemialliset ominaisuudet (kirjoita mahdollisten reaktioiden yhtälöt - molekyyli-, kokonais- ja pelkistetyt ionit).
1) Palaa kuumennettaessa (katso hapettumisen ja pelkistyksen näkökulmasta).

2) Yhteisvaikutukset ei-metallien kanssa (katso OVR).

3) Vaikuttaa happojen liuosten kanssa.

4) on vuorovaikutuksessa suolaliuosten kanssa.
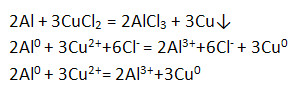
5) Yhteisvaikutukset metallioksidien kanssa - aluminotermia.
![]()
6) Vaikuttaa alkaliliuoksiin.

Osa II
1. Täytä taulukko ”Alumiinin käyttö sen kemiallisten ominaisuuksien perusteella”.

2. Kirjoita reaktioyhtälöt, joiden avulla voit tehdä vastaavat muutokset OVR: n valossa.

3. Amalgaami on yhdiste, joka sisältää elohopeaa.
Alumiinikemiassa sillä on tärkeä rooli pelkistysaineena orgaanisissa synteeseissä.
4. Laaditaan raportti kulta-amalgameista ja niiden merkityksestä eri tietolähteiden (Internet) avulla. Kirjoita viestin opinnäyte tai tee suunnitelma erityiseen muistikirjaan.
Yhdistämismenetelmä perustuu elohopean kykyyn muodostaa seoksia - amalgameja erilaisten metallien kanssa, mukaan lukien kulta. Tässä menetelmässä kostea murskattu kivi sekoitettiin elohopean kanssa ja altistettiin lisähionnalle kulhovalssaamoissa. Kultainen amalgaami (ja siihen liittyvät metallit) poistettiin pesemällä, minkä jälkeen elohopea tislattiin kerätystä amalgaamista ja käytettiin uudelleen. Yhdistämismenetelmä on ollut tiedossa 1. vuosisadalta eKr. e., on hankkinut suurimman mittakaavan Espanjan amerikkalaisissa siirtokunnissa XVI vuosisadan jälkeen. Tämä tehtiin mahdolliseksi, koska Espanjassa oli valtava elohopeatalletus - Almaden. Myöhemmin käytettiin ulkoisen yhdistämisen menetelmää, kun murskattu kultaa kantava kivi pestiin pesusulkujen läpi, vuorattu kuparilevyillä, jotka oli päällystetty ohuella elohopeakerroksella. Yhdistämismenetelmää voidaan käyttää vain kenttiin, joissa on korkea sisältö kultaa tai jo sen rikastuessa. Nyt sitä käytetään hyvin harvoin, pääasiassa kaivostyöläisten Afrikassa ja Etelä-Amerikassa.
5. Valmistele esitys (5-10 dioa) aiheesta ”Alumiinin historia” Internetin avulla. Kirjoita esityssuunnitelma muistiin.
1) Alumiinin löytö
2) Oleminen luonnossa
3) Fyysinen ja kemialliset ominaisuudet
4) Vastaanotto
5) Sovellus
6. Laske, kuinka monta grammaa kromi (III) oksidia, joka sisältää 20% epäpuhtauksia, ja mooli alumiinia on tarpeen, jotta saadaan 4,5 moolia kromia, käyttämällä aluminotermiaa.
Kemiallinen elementti alumiini on kevyt hopeametalli. Alumiini on yleisin maankuori metallia. Alumiinin fysikaaliset ja kemialliset ominaisuudet antoivat sen käyttää laajasti nykyajan teollisuudessa ja arjessa.
Alumiinin kemialliset ominaisuudet

Alumiinin kemiallinen kaava on Al. Atominumero 13. Alumiini tarkoittaa yksinkertaiset aineet, koska sen molekyyli sisältää vain yhden alkuaineen atomin. Alumiiniatomin ulkoinen energiataso sisältää 3 elektronia. Alumiiniatomi vapauttaa nämä elektronit helposti aikana kemialliset reaktiot. Siksi alumiinilla on korkea kemiallinen aktiivisuus ja se pystyy syrjäyttämään metallit niiden oksidista. Mutta normaaleissa olosuhteissa se on melko kestävä kemialliselle vuorovaikutukselle, koska se on peitetty kestävällä oksidikalvolla.
Alumiini on vuorovaikutuksessa hapen kanssa vain korkeissa lämpötiloissa. Reaktio tuottaa alumiinioksidia. Rikin, fosforin, typen, hiilen kanssa vuorovaikutus tapahtuu myös korkeassa lämpötilassa. Kloorin ja bromin kanssa alumiini reagoi kuitenkin tavanomaisissa olosuhteissa. Se reagoi jodin kanssa kuumennettaessa, mutta vain jos vesi toimii katalysaattorina. Alumiini ei ole vuorovaikutuksessa vedyn kanssa.
Metallien kanssa alumiini pystyy muodostamaan yhdisteitä, joita kutsutaan aluminideiksi.
Oksidikalvosta puhdistettu alumiini reagoi veden kanssa. Tästä reaktiosta syntyvä hydroksidi on heikosti liukoinen yhdiste.
Alumiini on helposti vuorovaikutuksessa laimeiden happojen kanssa muodostaen suoloja. Mutta se reagoi vain väkevöityjen happojen kanssa kuumennettaessa, muodostaen suoloja ja hapon pelkistystuotteita.
Alumiini reagoi helposti emästen kanssa.
Alumiinin fysikaaliset ominaisuudet

Alumiini on vahva metalli, mutta samalla myös muovi, se on helppo mekaanisesti käsitellä: meistämällä, kiillottamalla, piirtämällä.
Alumiini on kevyin metalleista. Sillä on erittäin korkea lämmönjohtavuus. Sähkönjohtavuudessa alumiini ei käytännössä ole huonompi kuin kupari, mutta samalla se on paljon kevyempi ja halvempi.
Alumiinisovellus

Ensimmäisen metallialumiinin hankki tanskalainen fyysikko Hans Christian Oersted vuonna 1825. Ja noina päivinä alumiinia pidettiin jalometalli. Fashionistas rakasti kulumista koruja häneltä.
mutta teollisuusmenetelmä Alumiinin tuotanto luotiin paljon myöhemmin - vuonna 1855 ranskalainen kemisti Henri Etienne St. Clair Deville.
Alumiiniseoksia käytetään melkein kaikilla konepajateollisuudessa. Nykyaikainen ilmailu-, avaruus- ja autoteollisuus, laivanrakennus ei voi tehdä ilman sellaisia \u200b\u200bseoksia. Kuuluisimmat seokset ovat duralumiini, silumiini, valetut seokset. Ehkä suosituin näistä seoksista on duralumiini.
Alumiinin prosessoinnissa kuumalla ja kylmällä prosessilla saadaan profiileja, lankaa, putkia, nauhoja, arkkeja. Alumiinilevyt tai teippiä käytetään laajasti nykyaikaisessa rakentamisessa. Joten erityistä alumiiniteippiä käytetään tiivistämään eri rakennuspaneelien päät antamaan luotettavan suojan sateen ja pölyn pääsyltä paneeliin.
Koska alumiinilla on korkea sähkönjohtavuus, sitä käytetään sähköjohtojen ja sähkörenkaiden valmistukseen.
Alumiini ei ole jalometalli. Mutta joitain sen yhdisteistä käytetään koruteollisuudessa. Luultavasti kaikki eivät tiedä, että rubiini ja safiiri ovat alumiinioksidin yksittäisiä kiteitä, joihin lisätään värjäviä oksideja. Kromi-ionit antavat punaisen värin rubiinille, ja safiirin sininen väri tulee rauta- ja titaani-ionien sisällöstä. Puhdasta kiteistä alumiinioksidia kutsutaan korundiksi.
Teollisissa olosuhteissa syntyy keinotekoista korundia, rubiinia ja safiiria.
Alumiinia käytetään myös lääketieteessä. Se on osa joihinkin lääkkeisiin, joilla on imukykyinen, peittävä ja kipua lievittävä vaikutus.
On vaikea löytää nykyajan teollisuuden haaraa, jossa alumiinia ja sen yhdisteitä ei käytetä.
Metallien ja kaasujen vuorovaikutuksen luonne hitsausolosuhteissa määrää suurelta osin huokosten luonteen.
Alumiinilla on suuri affiniteetti happea kohtaan. Hapen liukoisuus nestemäiseen alumiiniin on vähäinen (enintään 0,0003%) ja oksidien muodostuminen on ominaista alumiinin ja sen seosten vuorovaikutukselle hapen kanssa. Alumiinioksidi muodostaa useita kiteisiä muunnoksia, joiden olemassaolon ja siirtymisen toisesta toiseen määrää lämpötila, altistumisaika ja ympäristön koostumus.
Diffuusioprosessien nopeus ja kemialliset reaktiot, jotka määräävät hapettumisen kineettisen lain, ovat tässä tapauksessa vertailukelpoisia.
On huomattava, että lämpötila, jossa metallien voimakas kemiallinen vuorovaikutus alkaa vesihöyryn kanssa, on sitä alhaisempi, mitä kehittyneempi metallin pinta on. Al 2 O 3 -oksidin lämpölujuus on erittäin korkea. Jotkut oksidin ominaisuudet: sulamispiste 2310 - 2320 K; kiehumispiste 2500 - 3800 K; tiheys sulamispisteessä 3,01 g / cm3 nestemäisessä tilassa - 2,5 g / cm3; sulamislämpö 110 kJ / mol; höyrystymislämpö 485 kJ / mol; tiheys 20 ° C: ssa 3,96 g / cm3; kalvon tiheys (kalvon molekyylitilavuuden suhde metallin atomitilavuuteen) 1,25; laajenemiskerroin 6,58 x 10 -6 K-1; sähkövastus 1 × 10 7 ohmia / cm.
Alumiinin hapettuminen etenee suurella nopeudella hapen tai happea sisältävien monimutkaisten kaasujen merkityksettömällä osapaineella ja kasvaa vielä enemmän lämpötilan noustessa.
Alumiinin hapetuksen alkuvaiheessa muodostuu suljetyyppinen kompakti amorfinen kalvo Al203, joka ei läpäise ulkoilmaa. Oksidikalvon lisäkasvu on mahdollista metallikationien ja happianionien keskinäisen diffundin seurauksena muodostuneen oksidikerroksen läpi. Oksidin kasvun diffuusiovaihe on endoterminen, ts. on lämpöaktivoitu prosessi.
Alumiinin hapettuminen tapahtuu käytännössä kosteuden läsnä ollessa, jonka pitoisuus ilmassa on 4%. Näissä olosuhteissa vesimolekyylit adsorboituvat ensisijaisesti alumiinin pintaan, koska toisin kuin ei-polaariset typen, hapen ja vedyn molekyylit, ne ovat dipoleja, joilla on paljon suurempi adsorptiokyky.
Fyysisen adsorption jälkeen, jolle on tunnusomaista Van der Waals -voimien heikko vuorovaikutus, toinen vaihe alkaa - kemisorptio:
2Al + 3H 2O → 6H + Al203
Vapautunut atomivety diffundoituu helposti kalvoon ja hilaan
alumiini, jossa se on usein ionisoitunut. Tuloksena olevalla oksidikalvolla on korkea adsorptiokyky ja se adsorboi kosteutta, happea ja muita kaasuja sen pinnalle. Lisäksi happi dissosioituu atomiksi,
tunkeutuu kalvon epäjärjestykseen rakenteeseen ja voi muodostua
metastabiili faasi Al203 ja vetymonohydoksidi AlOOH, joka myöhemmin muuttuu trihydroksidiksi Al (OH) 3.
Siten hapetuksen aikana lämpötilassa 18 - 20 ° C kosteutta sisältävän ilman ilmakehässä muodostuu suojaavan tyyppisiä ohuita oksidikalvoja, joilla on monimutkainen koostumus Al203 - AlOOH → Al (OH) 3.
Alumiinin lisähapettuminen ja oksidikalvon kasvu ovat mahdollisia korotetuissa lämpötiloissa johtuen metallikationien diffuusiosta kalvon läpi kaasu-oksidipinnalle ja päinvastoin, anionien diffuusiosta oksidi-kalvo-metalli-rajapintaan.
Oksidikalvon paksuuden nousunopeus kasvaa lämpötilan noustessa, ja metallin siirtyminen kiinteästä nesteeseen ei aiheuta muutosta tässä trendissä. Koska hapettumisen kinetiikka määritetään kationien diffuusiolla, hapen osapaineen ei pitäisi vaikuttaa merkittävästi tähän prosessiin.
Alumiinin hapettumisen koostumukseen, rakenteeseen ja yleensä mekanismiin ja kinetiikkaan vaikuttavat seosten alkuaineet seoksissa ja metalli-epäpuhtaudet. Seosten pääosat seostavat elementit ovat kupari, magnesium, mangaani, pii, sinkki, litium. Joihinkin lejeerinkeihin lisätään pieniä määriä titaania, berylliumia, kromia, nikkeliä, kadmiumia, skandiumia ja muita.Seostuvien elementtien kokonaispitoisuus deformoituvissa alumiiniseoksissa ei yleensä ylitä 10%.
Elementit, kuten magnesium, beryllium, litium, voivat alumiiniseoksissa hapettua korkeampien negatiivisten muodostumisenergioiden vuoksi kuin alumiini, jopa hyvin alhaisilla tasoilla. Nestemäisessä alumiinissa olevalla litiumilla, natriumilla ja magnesiumilla on pinta-aktiivisten elementtien rooli. Niiden pitoisuus pintakerroksessa on korkeampi kuin sulan keskimääräinen pitoisuus.
Oksidikalvon ominaisuudet alumiinilla, joilla on suuri merkitys alumiinissa
huokosien muodostumisen luonteen ja mekanismin määrittäminen hitsauksen aikana:
1. Alumiinioksidikalvolla on korkeat suojaavat ominaisuudet ja tietyssä hapettumisvaiheessa voidaan estää alumiinin jatkuva vuorovaikutus kaasujen kanssa.
2. Alumiinioksidilla on korkea sulamispiste eikä se sula hitsausolosuhteissa. Tässä suhteessa pintakalvo varastoidaan hitsausaltaan tilavuuden sisällä (kalvo, joka on pudonnut kylpyyn takaosa reunat ja niiden päätypinnat) ja sen pinnalla (hitsattujen reunojen ulkopinnan kalvo) huolimatta suuremmasta tiheydestä kuin nestemäisen alumiinin tiheys. Jälkimmäisessä tapauksessa kalvo pidetään kylvyn pinnalla pintajännityksellä.
3. Alumiinioksidi ei liukene kiinteään tai nestemäiseen metalliin. Kalvolla on myös korkea mekaaninen lujuus.
4. Tällaisten seostavien elementtien, kuten litiumin ja magnesiumin, läsnäolo alumiiniseoksissa tekee alumiinin oksidikalvosta adsorptiokykyisemmän ja lisää sen roolia potentiaalisena kaasulähteenä.
5. Alumiinioksidioksidikalvon tärkeä ominaisuus on sen korkea adsorptiokyky vesihöyryyn. Alumiinin hapettuneen pinnan adsorboima vesihöyry pidetään korkeissa lämpötiloissa. Osa alumiinin pinnalla olevasta kosteudesta säilyy myös sen jälkeen, kun metalli on pidetty tyhjössä enintään 350 ° C: n lämpötilassa. Jäljellä oleva osa, joka on selvästi sidottu hydraatin muodossa ja sijaitsee syvissä mikrohalkeamissa oksidikalvossa, poistetaan korkeammissa lämpötiloissa ja voi reagoida metallin kanssa vedyn tuottamiseksi. Alumiinioksidihydraatti sisältää tietyn määrän vettä jopa




