Yksittäisten kemiallisten alkuaineiden ominaisuudet. Alkuaineiden kemialliset ominaisuudet
"Kemia. Luokka 9." OS Gabrielyan (gdz)
ominaisuus kemialliset alkuaineet. Mendeleevin kauden laki
Kysymys 1
Mendeleevin jaksollinen laki on yksi kemian peruslakeista. Voidaan väittää, että kaikki moderni kemia perustuu siihen. Hän selittää atomien ominaisuuksien riippuvuuden niiden rakenteesta, yleistää tämän riippuvuuden kaikille elementeille jakamalla ne eri ryhmiin ja ennustaa myös niiden ominaisuudet rakenteesta riippuen ja rakenteen ominaisuuksista riippuen.
On muitakin lakeja, joilla on selittävät, yleistävät ja ennustavat toiminnot. Esimerkiksi laki energian säilyttämisestä, valon taittumisen laki, Mendelin geneettinen laki, yleisen painovoimalaki jne.
Kysymys 2
Jaksollisen järjestelmän ohjaamana löydämme elementin, jolla on haluttu elektronien sijoitus energiatasoilla (2 ja 5). Tämä elementti on typpi: N: 1s 2 2s 2 2p 3.
Tämä elementti muodostaa yksinkertaisen aineen - N 2, typpi. Typen vetyyhdiste on NH3, ammoniakki. Suurempi typpioksidi - N 2 O 5. Tämä oksidi kuuluu happamiin oksideihin, koska veteen liuenneessa se muuttuu vahvaksi typpihapoksi HNO3.
N205 + H20 \u003d 2HN03;
N205 + BaO \u003d Ba (OH) 2;
N205 + Ba (OH) 2 \u003d Ba (N03) 2 + H20;
Typen hapetustilassa +5 (N +5) on vahvat hapettavat ominaisuudet:
2N205 + 5C \u003d 2N2 + 5C02.
Kysymys 3.
Aikaisemmin beryllium-elementti oli erehdyksessä luokiteltu ryhmään III. Syynä tähän oli berylliumin atomimassan virheellinen määrittäminen (9: n sijaan sen katsottiin olevan yhtä suuri kuin 13,5). DI Mendeleev ehdotti, että beryllium kuuluu ryhmään II elementin kemiallisten ominaisuuksien perusteella. Berylliumin ominaisuudet olivat hyvin samankaltaisia \u200b\u200bmagnesiumin (Mg) ja kalsiumin (Ca) ominaisuuksien kanssa ja täysin toisin kuin alumiinin (Al) ominaisuudet. Tietäen, että Li: n ja B: n atomimassat, jotka ovat vierekkäisiä elementtejä, ovat yhtä suuret kuin 7 ja 11, D.I. Mendelejev ehdotti, että atomimassa beryllium on 9.
Kysymys 4
Ca on atomi, jossa elektronit jakautuvat sarjan mukaisesti
numerot 2, 8, 8, 2.
Elementti nro 7-N,
elementin numero 8 - O.
Reaktioyhtälöt:
3Ca + N2 \u003d Ca3N2,
2Ca + O2 \u003d 2CaO.
Reaktiotuotteilla on ioninen tyyppi viestintä.
Typen ja hapen molekyylirakenne on kidehilat, ja kalsiumilla on metallikidehila.
Vuorovaikutustuotteilla - Ca 3N 2 ja CaO on kidehilan ioninen rakenne.
Kysymys 5.
N, P, As, Sb, Bi - metalliominaisuuksien vahvistaminen.
Ryhmien metalliominaisuudet paranevat.
Kysymys 6.
Useissa elementeissä: N, Mg, Al, Si, P, S, Cl - ei-metallisten ominaisuuksien vahvistaminen.
Elementtien ei-metalliset ominaisuudet jaksoilla paranevat.
Kysymys 7.
Cl 2 O 7, P 2 O 5, Si02, Al 2 O 3, MgO, Na 2 O - happoominaisuuksien lasku.
Happamat ominaisuudet lisääntyvät jaksoissa.
HCl04, H3PO4, H2S04, Al (OH) 3, NaOH - happoominaisuuksien lasku.
Kysymys 8.
B 2 O 3, BeO, Li 2 O - emäksisten ominaisuuksien lisäys.
B (OH) 3, Be (OH) 2, LiOH - emäksisten ominaisuuksien lisäys.
B (OH) 3 - heikko happo;
Be (OH) 2 on heikko emäs;
LiOH on vahva emäs.
Kysymys 9.
Jaksoittainen elementtijärjestelmä kuvastaa kemiallisten elementtien suhdetta. Elementin atominumero on yhtä suuri kuin ytimen varaus, numeerisesti se on yhtä suuri kuin protonien lukumäärä. Yhden elementin ytimissä olevien neutronien lukumäärä, toisin kuin protonien lukumäärä, voi olla erilainen. Yhden alkuaineen atomia, jonka ytimet sisältävät eri määrän neutroneja, kutsutaan isotoopeiksi.
Jokaisessa kemiallisessa elementissä on useita isotooppeja (luonnollisia tai keinotekoisesti tuotettuja). Kemiallisen alkuaineen atomimassa on yhtä suuri kuin kaikkien sen luonnollisten isotooppien keskimääräinen massa, ottaen huomioon niiden runsaus.
Isotooppien löytämisen myötä ydinvarauksia, ei niiden atomimassoja, alettiin käyttää jakamaan elementtejä jaksollisessa järjestelmässä.
Kysymys 10.
Tämä johtuu tosiasiasta, että elementtien ja niiden yhdisteiden ominaisuudet eivät riipu elektronien kokonaismäärästä, vaan vain viimeisen kerroksen valenssien lukumäärästä. Valenssielektronien lukumäärä vaihtelee ajoittain, siksi myös elementtien ominaisuudet muuttuvat ajoittain.
Kysymys 11.
1. Kemiallisten elementtien ja niiden muodostamien aineiden ominaisuudet ovat määräajoin riippuvaisia \u200b\u200belementtien suhteellisista atomimassoista.
2. Kemiallisten elementtien ja niiden muodostamien aineiden ominaisuudet ovat määräajoin riippuvaisia \u200b\u200belementtien atomien varauksista.
aihe: Kemialliset ominaisuudet elementtejä.
suunnitelma:
1. Metallien ja niiden yhdisteiden ominaisuudet (I ja II luku. subgraphs.)
1.1 IA: n elementit
1.2 Elementit IIA ryhmät - yleinen ominaisuus.
2. p-elementtien kemialliset ominaisuudet.
2.1 Elementit IIIA ryhmät - yleinen ominaisuus.
2.2 IVA: n elementit ryhmät - yleinen ominaisuus.
2.3 VA-elementit ryhmät - yleinen ominaisuus.
2.4 VIA-elementit ryhmät - yleinen ominaisuus.
2.5 VIIA-elementit ryhmät - yleinen ominaisuus.
2.6 Elementit VIIIA ryhmät - yleinen ominaisuus.
3.Vodorod
Alkalimetallit - kemiallisten alkuaineiden jaksollisen ryhmän I pääryhmän elementit D. I. Mendelejev: litium Li, natriumna, kalium K, rubidium Rb, cesium Cs ja France Fr. Näitä metalleja kutsutaan alkalisiksi, koska suurin osa niiden yhdisteistä liukenee veteen. Slaavilaisella kielellä 'uutto' tarkoittaa 'liuottamista', ja tämä määritti tämän metalliryhmän nimen. Kun alkalimetallit liukenevat veteen, muodostuu liukoisia hydroksideja, joita kutsutaan emäksiksi. G. Davy sai vuonna 1807 ensimmäistä kertaa ilmaisen kaliumin ja natriumin.
Ulkoisessa elektronikerroksessa alkalimetalliatomeilla on kullakin yksi elektroni. Litiumiatomin ulkopuolella oleva toinen elektronikerros sisältää kaksi elektronia ja jäljellä olevien alkalimetallien atomit - kahdeksan elektronia. Koska ulommassa elektronikerroksessa on vain yksi elektroni, joka sijaitsee suhteellisen suurella etäisyydellä ytimestä, näiden elementtien atomit vapauttavat melko helposti tämän elektronin, ts. Niille on ominaista alhainen ionisaatioenergia. Tässä muodostuneilla yksin varautuneilla positiivisilla ioneilla on vastaavan jalokaasun vakaa elektroninen rakenne (litiumioni on heliumiatomin rakenne, natriumioni on neoniatomi jne.). Ulkoisten elektronien takaisinoton helppous kuvaavat tarkasteltavia elementtejä eniten tyypillisiä edustajia metallit: metalliset ominaisuudet ovat erityisen selvät alkalimetallien suhteen.
Kaikkien alkalimetallien, lukuun ottamatta litiumia, ulomman, mutta myös viimeisimmän elektronikerroksen identtinen rakenne tekee näiden elementtien ominaisuuksista suuren samankaltaisuuden. Samaan aikaan ytimen varauksen ja atomien elektronien kokonaismäärän lisääntyminen, kun ne siirtyvät alaryhmästä ylhäältä alas, luo joitain eroja niiden ominaisuuksissa. Kuten muissakin ryhmissä, nämä erot ilmenevät pääasiassa valenssielektronien palautumisen helppouden lisääntymisessä ja metallisten ominaisuuksien paranemisessa sarjanumeron kasvaessa.
|
Alkalimetallien ominaisuudet |
||||||||
|
ydinaseiden |
nimi, |
metalli |
ioninen |
mahdollinen |
EO |
p, |
t pl |
t paali |
|
Litium li |
0,152 |
0,078 |
5,32 |
0,98 |
0,53 |
1347 |
||
|
Natrium Na |
0,190 |
0,098 |
5,14 |
0,93 |
0,97 |
|||
|
Kalium K |
0,227 |
0,133 |
4,34 |
0,82 |
0,86 |
|||
|
Rubidium Rb |
0,248 |
0,149 |
4,18 |
0,82 |
1,53 |
|||
|
Cesium cs |
0,265 |
0,165 |
3,89 |
0,79 |
1,87 |
|||
Alkalimetallien kemialliset ominaisuudet. Koska alkalimetallien kemiallinen aktiivisuus veteen, happea ja typpeä on korkea, ne varastoidaan kerosiinikerroksen alle. Reaktion suorittamiseksi alkalimetallin kanssa tarvittavan kokoinen kappale leikataan varovasti skalpellilla kerosiinikerroksen alla, argonilmakehässä, metallipinta puhdistetaan perusteellisesti tuotteista, jotka ovat vuorovaikutuksessa ilman kanssa, ja vasta sitten näyte asetetaan reaktioastiaan.
1. Yhteisvaikutukset veden kanssa. Alkalimetallien tärkeä ominaisuus- heidän korkea aktiivisuus veteen nähden. Kaikkein rauhallisimmin (ilman räjähdystä) litium reagoi veden kanssa:
Samanlaisessa reaktiossa natrium palaa keltaisella liekillä ja tapahtuu pieni räjähdys. Kalium on vielä aktiivisempaa: tässä tapauksessa räjähdys on paljon voimakkaampi ja liekki on väriltään purppura. 2. Yhteisvaikutukset hapen kanssa. Ilmassa olevien alkalimetallien palamistuotteilla on erilainen koostumus riippuen metallin aktiivisuudesta.
Vain litium palaa ilmassa muodostaen stökiömetristä oksidia:
Natriumia poltettaessa muodostuu Na2O2-peroksidia pääasiassa pienellä NaO2-superoksidiseoksella:
Kaliumin, rubidiumin ja cesiumin palamistuotteet sisältävät pääasiassa superoksidia: ![]()
Natrium- ja kaliumoksidien saamiseksi hydroksidin, peroksidin tai superoksidin seoksia kuumennetaan ylimäärällä metallia hapen puuttuessa: 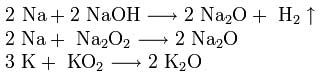
Seuraava säännöllisyys on ominaista alkalimetallien happeayhdisteille: alkalimetallikationin säteen kasvaessa peroksidi-ioni O22: n ja superperoksiidi-ionin O2 sisältävien happiyhdisteiden stabiilisuus kasvaa.
Raskaille alkalimetalleille koostumuksen EO3 melko stabiilien otsonidien muodostuminen on ominaista. Kaikilla happiyhdisteillä on erilainen väri, jonka intensiteetti syvenee sarjassa Li: stä Cs: iin:
|
kaava |
väri |
|
Li20 |
valkoinen |
|
Na20 |
valkoinen |
|
K20 |
kellertävä |
|
Rb 2 o |
keltainen |
|
Cs 2 o |
oranssi |
|
Na202 |
valo |
|
KO 2 |
oranssi |
|
RBO 2 |
Tomno- |
|
CSO 2 |
keltainen |
Alkalimetallioksidilla on kaikki emäksisten oksidien ominaisuudet: ne reagoivat veden, happooksidien ja happojen kanssa: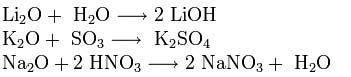
Peroksideilla ja superoksideilla on vahvojen hapettimien ominaisuudet:
Peroksidit ja superoksidit ovat intensiivisesti vuorovaikutuksessa veden kanssa muodostaen hydroksideja:
3. Yhteisvaikutukset muiden aineiden kanssa. Alkalimetallit reagoivat monien ei-metallien kanssa. Kuumennettaessa ne yhdistyvät vedyn kanssa muodostaen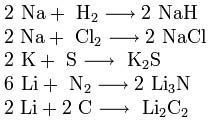 hydridit halogeenien, rikin, typen, fosforin, hiilen ja piin kanssa halogeenien, sulfidien, nitridien, fosfidien, karbidien ja silidien muodostamiseksi:
hydridit halogeenien, rikin, typen, fosforin, hiilen ja piin kanssa halogeenien, sulfidien, nitridien, fosfidien, karbidien ja silidien muodostamiseksi:
Kuumennettaessa alkalimetallit kykenevät reagoimaan muiden metallien kanssa muodostaen metallien välisiä yhdisteitä. Happojen alkalimetallit reagoivat aktiivisesti (räjähdyksen kanssa).
Alkalimetallit liukenevat nestemäiseen ammoniakkiin ja sen johdannaisiin - amiineihin ja amideihin:
Kun liuotettu nestemäiseen ammoniakkiin, alkalimetalli menettää elektronin, jonka solvatoivat ammoniakkimolekyylit ja antaa liuokselle sinisen värin. Syntyneet amidit hajoavat helposti vedellä muodostaen alkalia ja ammoniakkia:
Alkalimetallit ovat vuorovaikutuksessa orgaanisten aineiden kanssa alkoholien (muodostuessa alkoholaatteja) ja karboksyylihappojen (muodostuessa suolojen) kanssa:
4. Alkalimetallien kvalitatiivinen määritys. Koska alkalimetallien ionisaatiopotentiaalit ovat pienet, kun metalli tai sen yhdisteet kuumennetaan liekissä, atomi ionisoituu, väristäen liekin tietyllä värillä:
|
Alkali liekin väritys |
|
|
Karmiini punainen |
|
|
keltainen |
|
|
violetti |
|
|
Valkeahko vaaleanpunainen |
|
|
Violetti punainen |
|
Alkalimetallien tuotanto
1. Alkalimetallien saamiseksi he käyttävät pääasiassa niiden halogenidien sulan elektrolyysiä, useimmiten klorideja, jotka muodostavat luonnollisia mineraaleja:
katodi: Li + + e → Lianodi: 2Cl- - 2e → Cl22. Joskus alkalimetallien saamiseksi,
niiden hydroksidin elektrolyysi sulaa:
katodi: Na + + e → Na-anodi: 4OH- - 4e → 2H2O + O2 Koska sähkökemiallisten jännitesarjojen alkalimetallit sijaitsevat vedyn vasemmalla puolella, on mahdotonta saada niitä suolaliuoksista; tässä tapauksessa muodostuu vastaavat emäkset ja vety.
Luonnossa alkalimetallit löytyy yksinomaan yhdisteiden muodossa. Natrium ja kalium ovat monien hyvin yleisten silikaattien vakioaineosat. Yksittäisistä natriummineraaleista tärkein - natriumkloridi (NaCl) - on osa merivettä ja valituilla alueilla maanpinta muodostaa valtavia ns. kivisuolan kerrostumia alluiaalisten kivien kerroksen alle (Neuvostoliitossa - Solikamsk, Artemoven, Iletsk jne.). Tällaisten saostumien yläkerrokset sisältävät toisinaan kaliumsuolojen keräyksiä [mineraalien muodossa sylviiniä (KCl - NaCl), karnaliittia (KCl · MgCl2 · 6Н2 О) jne.], Jotka toimivat tämän alkuaineen pääasiallisena lähteenä. Luonnollisesti tärkeät klusterit kaliumsuolat vain vähän tiedetään. Tärkein näistä on Solikamskin talletus Neuvostoliitossa.
Litiumille tunnetaan useita mineraaleja [esimerkiksi spodumeeni on LiAl (SiO3) 2], mutta niiden kertymiset ovat harvinaisia. Rubidiumia ja cesiumia esiintyy melkein yksinomaan epäpuhtauksina muille alkalimetallit. Ranskan jäljet \u200b\u200bovat aina mukana uraanimalmi.
Natrium- ja kaliumyhdisteillä on suuri merkitys elämälle. Riittää, kun muistetaan, että henkilö kuluttaa 5-10 kg NaCl: a vuodessa. Samalla tavalla kasveihin tarvitaan kaliumsuoloja. Tältä osin noin 90% kaikista louhituista potasiyhdisteistä käytetään maaperän lannoittamiseen. Loput 10% samoin kuin valtavat määrät erilaisia \u200b\u200bnatriumyhdisteitä käytetään teollisuudessa. Toistaiseksi vain suhteellisen pieni tilavuuskäyttö on litiumin johdannaisia \u200b\u200bja erittäin rajallisia Rb: n ja Cs: n yhdisteitä.
Vapaassa tilassa alkalimetallit voidaan eristää elektrolysoimalla niiden sulatetut kloridisuolat. Tärkein käytännöllinen arvo on natrium, jonka maailmanlaajuinen tuotanto on yli 50 tuhatta tonnia.
Ryhmän II pääryhmä sisältää elementtejäb epu lli magnesium, kalsium, strontium, bariumja radium. Kaikilla näillä elementeillä, paitsi berylliumilla, on selvät metalliset ominaisuudet. Vapaassa tilassaja ne ovat hopeaa kristovalkoiset aineet, kovempia kuin alkalimetallit, melko korkeat sulamispisteet. Tiheyden mukaan kaikki, lukuun ottamatta radiumia, kuuluvat kevytmetalleihin.
Tarkasteltavan alaryhmän kaksi ensimmäistä jäsentä ovat siinä jonkin verran erityisen aseman, joka eroaa monilta osin jäljellä olevista neljästä elementistä. Berillium joillekin omista lähempänä alumiinia.
Kaikki alaryhmän viimeisen elementin - radiumin - kaikki isotoopit ovat radioaktiivisia. Pitkäikäinen isotooppi226 Ra aiemmin käytetty sädehoidossa; Tällä hetkellä se on korvattu halvemmalla isotoopeilla muista ydinreaktoreissa muodostuvista elementeistä.
Ulommassa elektronikerroksessa tämän alaryhmän elementtien atomilla on kaksi elektronia, toisessa kerroksessa berylliumkerroksen ulkopuolella on kaksi elektronia, ja jäljellä olevilla elementeillä on kahdeksan elektronia.
Näiden elementtien atomien muodostamat yksinkertaiset aineet ovat metalleja. Litiumia, natriumia, kaliumia, rubidiumia, cesiumia ja Ranskaa kutsutaan alkalimetalliksi, koska niiden hydroksidit ovat emäksiä. Kalsiumia, strontiumia ja bariumia kutsutaan maa-alkalimetalliksi. Näiden aineiden kemiallinen aktiivisuus kasvaa atomisäteen kasvaessa. Näiden metallien kemiallisista ominaisuuksista niiden pelkistävät ominaisuudet ovat tärkeimmät. Alkalimetallit ovat voimakkaimpia pelkistäviä aineita. Ryhmän IIA elementtien metallit ovat myös melko vahvoja pelkistäviä aineita. Kaikki ne (paitsi beryllium) reagoivat veden (keitetyn magnesiumin) kanssa:
2M + 2H20 \u003d 2 M aq + 2OH aq + H2, M + 2H20 \u003d M2 + 2OH + H2.
Magnesiumin, kalsiumin ja strontiumin tapauksessa tuloksena olevien hydroksidien vähäisen liukoisuuden vuoksi reaktioon liittyy saostuman muodostuminen:
M2 + 2OH \u003d Mg (OH) 2
Alkalimetallit reagoivat useimpien ei-metallien kanssa: 2M + H2 \u003d 2MH (kuumennettaessa), 4M + O2 \u003d 2M20 (M - Li), 2M + Cl2 \u003d 2MCl (at normaalit olosuhteet), 2M + S \u003d M2 S (kuumennettaessa).
Alkalimetallien hapessa palaessa tavallinen oksidi muodostaa vain litiumia. Jäljellä olevat alkalimetallit muodostavat peroksideja (M2 O 2 ) tai superoksideja (MO2
- yhdisteet, jotka sisältävät superoksidi-ionia, muodollisen varauksen ollessa –1 e. Samoin kuin alkalimetallit, ryhmän IIA elementtien metallit reagoivat monien ei-metallien kanssa, mutta vaikeammissa olosuhteissa: M + H2 \u003d MH2 (kuumennettuna; paitsi beryllium),
2M + O2
\u003d 2MO (tavallisissa olosuhteissa; Be ja Mg - kuumennettaessa), M + Cl2 \u003d MCl2 (normaaleissa olosuhteissa), M + S \u003d MS (kuumennettaessa). Toisin kuin alkalimetallit, joissa on happi, ne muodostavat tavallisia oksideja. Vain magnesium ja beryllium reagoivat rauhallisesti happojen kanssa, loput yksinkertaiset aineet erittäin väkivaltaisesti, usein räjähdyksellä.Beryllium reagoi väkevien alkaliliuoksien kanssa: Be + 2OH + 2H20 \u003d 2 + H2
Jännityssarjan tilanteen mukaan vain beryllium ja magnesium reagoivat suolaliuosten kanssa, jäljellä olevat metallit reagoivat tässä tapauksessa veden kanssa. Koska ne ovat vahvoja pelkistäviä aineita, alkali- ja maa-alkalimetallit vähentävät yhdisteistä paljon vähemmän aktiivisia metalleja, esimerkiksi kuumennettaessa tapahtuu reaktioita: 4Na + MnO2 \u003d 2Na20 + Mn; 2Ca + Sn02 \u003d 2CaO + Sn. Kaikkien ryhmän IIA alkalimetallien ja metallien kokonaismäärä teollisuusmenetelmä tuotanto - sulan suolojen elektrolyysi.
Berrylliumin lisäksi kaikkien tarkasteltavien elementtien oksidit ovat emäksisiä oksideja, ja hydroksidit ovat vahvoja emäksiä (berylliumissa nämä yhdisteet ovat amfoteerisia, magnesiumhydroksidi on heikko emäs). Hydroksidien emäksisten ominaisuuksien lisääntyminen ryhmän elementin järjestysnumeron lisääntymisen avulla on helposti jäljitettävissä ryhmän IIA elementtien hydroksidisarjoissa. Ole (OH)2
amfoteerinen hydroksidi, Mg (OH)2
- heikko emäs, Ca (OH)2, Sr (OH) 2 ja Ba (OH) 2 vahvat emäkset, mutta sarjanumeron kasvaessa niiden liukoisuus kasvaa, ja Ba (OH)2
Voidaan jo johtua emäksistä.
Kaikki maa-alkalimetallit ovat (eri määrin) luonteeltaan. Korkean kemiallisen aktiivisuutensa vuoksi kaikkia niitä ei löydy vapaassa tilassa. Yleisin maa-alkalimetalli on kalsium, jonka määrä on 3,38% (maankuoren painosta). Magnesiumia on hiukan huonompi kuin se, jonka määrä on 2,35% (maankuoren massasta). Barium ja strontium ovat myös luonnossa laajalle levinneitä, joista 0,05% ja 0,034% maankuoren massasta. Beryllium on harvinainen alkuaine, jonka määrä on 6 × 10–4% maankuoren massasta. Radiumista, joka on radioaktiivinen, on harvinaisinta kaikkia maa-alkalimetalleja, mutta sitä on aina pieninä määrinä uraanimalmista. Erityisesti se voidaan eristää kemiallisesti sieltä. Sen pitoisuus on 1 × 10–10% (maankuoren massasta) /
D. I. Mendelejevin jaksollisen järjestelmän ryhmän III p-elementteihin kuuluvat: boori B, alumiini Al, gallium Ga, indium In ja tallium Tl. Atomien elektroninen konfiguraatio ns2 np1.
Joitakin vakioita, jotka kuvaavat kyseisen ryhmän p-elementtiatomien ja vastaavien metallisten aineiden ominaisuuksia, verrataan alla:
D-kompressio vaikuttaa ryhmän III p-elementtien ominaisuuksiin (Al sijaitsee jaksollisessa järjestelmässä pienellä III ajanjaksolla ja Ga, In ja Tl suurilla ajanjaksoilla heti d-elementtien jälkeen). Joten Al: sta Ga: han atomisäde pienenee hiukan, ja ensimmäinen ionisaatiopotentiaali kasvaa. F-kompressio vaikuttaa myös talliumiatomien ominaisuuksiin. Siksi Tl-atomin säde on lähellä In-atomin sädettä ja ionisaatioenergia on hiukan korkeampi.
Bor. Atomin elektronisen rakenteen (1s2 2s2 2p1) mukaan boori voi olla yksiarvoinen (yksi pariton elektroni energian 2p alikerroksessa). Boori on kuitenkin tyypillisin yhdisteille, joissa se on kolmiarvoinen (atomin virittyessä, kolme paritonta elektronia energian 2s ja 2p alatasossa).
Vapaalla 2p-kiertoradalla viritetyssä booriatomissa määritetään monien sen yhdisteiden, jotka muodostavat kolme kovalenttia sidosta vaihto-kovalenttisen mekanismin (esimerkiksi BBr3), vastaanottajaominaisuudet. Nämä yhdisteet ovat alttiita hiukkasten lisäämiselle, joilla on elektroneja luovuttavia ominaisuuksia, ts. Toisen kovalenttisen sidoksen muodostumiseen luovuttaja-vastaanottajamekanismi. Esimerkiksi:
BBr3 + Br- \u003d [BBr4] -
Kaksi boori-isotooppia tunnetaan: 105 V (19,6%) ja 115 B (80,4%). Isotooppiatomien ytimet (105 V) absorboivat helposti neutroneja:
105 V + 1 0 n \u003d 4 2 He + 7 5 Li
Boorin kyky absorboida neutroneja määrää sen käytön ydinenergialla: ydinreaktorien säätösauvat on valmistettu booria sisältävistä materiaaleista.
Boorikiteet, musta; ne ovat tulenkestäviä (sp. 2300 ° C), diamagneettisia, niillä on puolijohdeominaisuuksia (kaistaväli AE \u003d 1,55 eV). Boorin, kuten muidenkin metallien, sähkönjohtavuus on pieni ja kasvaa hieman lämpötilan noustessa.
Huoneenlämpötilassa boori on kemiallisesti inertti ja on vuorovaikutuksessa vain fluorin kanssa; Kuumennettaessa boori hapettuu kloorilla, hapella ja joillakin muilla ei-metalleilla. Esimerkiksi:
4V + 3O2 \u003d 2 V203
2В + ЗСl2 \u003d 2ВСl3
Yhdisteissä, joissa on ei-metalleja, boorin hapetustila on +3; kaikki nämä yhdisteet ovat kovalentteja.
Booritrioksidi B2 O3 on kiteinen aine (sp. 450 ° С, sp. 2250 ° С), jolle on tunnusomaista korkea entalpia ja Gibbsin muodostumisenergia. Veden kanssa vuorovaikutuksessa B2 O3 kulkee boorihappoon:
B2 O3 + ЗН2 O \u003d 2Н3 ВO3
H3 BO3 on erittäin heikko (Kd ≈ 10–9) yksiemäksinen happo. H3B03: n elektrolyyttinen dissosiaatio vain yhden H + -ionin poistolla selitetään boorin aiemmin hyväksytyillä vastaanottajaominaisuuksilla: booriatomin vapaa 2p-kiertorata toimitetaan OH-elektronidonorille, joka muodostuu H20-molekyylien dissosioitumisen aikana. Prosessi etenee kaavion mukaisesti.
H3B03 + H20 \u003d H [B (OH) 4] \u003d H + + [B (OH) 4] -
Kompleksi-anionilla [B (OH) 4] - on tetraedrinen rakenne (elektronisten kiertoratojen sp3-hybridisaatio). Boorin vastaanottajaominaisuudet yhdisteissä, joiden hapetustila on + 3, ilmenevät myös sen halogenidien kemiassa. Joten esimerkiksi reaktiot ovat helposti toteutettavissa
BF3 + F- \u003d -
BF3 + NH3 \u003d
jossa kemiallinen sidos BF: n ja F- tai NH3: n välillä muodostuu luovuttaja-vastaanottajamekanismista. Boorihalogenidien ominaisuus olla elektroneaktoreita määrittelee niiden laajan käytön katalyyttinä orgaanisten yhdisteiden synteesissä.
Boori ei ole vuorovaikutuksessa suoraan vedyn kanssa, mutta se muodostaa borideja metallien kanssa - yleensä ei-stoikiometriset yhdisteet Me4B, Me2B, MeB, Me3 B4, MeB2 ja MeB6.
Boorihydridit (boraanit) ovat erittäin myrkyllisiä ja niillä on erittäin epämiellyttävä haju. Niitä saadaan epäsuorasti, useimmiten
reaktiivisten boridien vuorovaikutuksessa happojen tai boorihalogenidien kanssa alkalimetallihydridien kanssa:
6MgB2 + 12НСl \u200b\u200b\u003d Н2 + 8В + В4 Н10 + 6MgCl2
8BF3 + 6LiH \u003d B2 H6 + 6LiBF4
Boorin yksinkertaista yhdistettä vety BH3: lla ei ole tavanomaisissa olosuhteissa. Bo2-atomin elektronisten kiertorata-alueiden sp2-hybridisaatio johtaa BH3-hiukkasen koordinaatiotyydyttymättömyyteen, jonka seurauksena kaksi tällaista hiukkasta yhdistyvät diboraanimolekyyliksi: 2ВНз \u003d В2 Н6 (ΔG0 298 \u003d -127 kJ / mol).
B2H6-diboraanissa boori on 5p3-hybridisaation tilassa, jolloin jokainen booriatomeista yksi neljästä hybridiorbitaalista on tyhjä ja muut kolme ovat päällekkäin vetyatomien s-orbitaalien kanssa. B3-H6-molekyylin H3-ryhmien väliset sidokset muodostuvat vety- sidoksen tyypistä johtuen elektronitiheyden siirtymisestä H3-ryhmän yhdestä vetyatomista toisen H3-ryhmän tyhjään kiertorataan. Tunnetaan muita boraaneja, joita voidaan edustaa kahdella rivillä Bn Hn + 4 ja Bn Hn + 6.
S-metallien boridit ovat kemiallisesti aktiivisia ja niitä käytetään usein boraaniseoksen aikaansaamiseen happokäsittelyn aikana. Useimmat d- ja f-metalliboridit ovat lämmönkestäviä, erittäin kovia ja kemiallisesti stabiileja. Niitä käytetään laajalti suoraan seosten muodossa suihkumoottorien, kaasuturbiinien siipien osien valmistukseen. Joitakin borideja käytetään elektronisten laitteiden katodien valmistukseen.
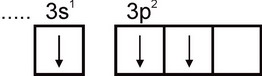
Alumiinia. Alumiiniatomin elektroninen konfiguraatio ilmaistaan \u200b\u200bkaavalla 1s2 2s2 2p6 3s2 3p1. Atomin ulkoisessa elektronikerroksessa on yksi parittumaton elektroni:
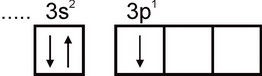
Siksi alumiinilla voi olla yhtenäisyyttä vastaava valenssi. Tämä valenssi ei kuitenkaan ole ominaista alumiinille. Kaikissa stabiileissa yhdisteissä alumiinin hapetustila on +3. Kolmen valenssi vastaa Al-atomin viritettyä tilaa:
Alumiini on yleisyydestään neljäs kaikista alkuaineista (O: n, H: n ja Si: n jälkeen) ja se on luontaisin runsas metalli. Suurin osa alumiinista on keskittynyt alumiinisilikaateihin: maasälvet, kiille jne.
Alumiini on hopeanvalkoinen kevyt ja erittäin plastilatiivinen metalli, jolla on korkea lämmönjohtavuus ja sähkönjohtavuus.
Alumiini on kemiallisesti aktiivinen; se reagoi kloorin ja bromin kanssa huoneenlämpötilassa, ja jodin kanssa - kuumennettaessa tai veden läsnä ollessa katalysaattorina. 800 ° C: ssa alumiini on vuorovaikutuksessa typen kanssa ja 2000 ° С: ssa - hiilen kanssa. Alumiinilla on korkea kemiallinen affiniteetti happea kohtaan (ΔG0 298 \u003d -1582 kJ / mol):
2Al + 0,502 \u003d AI203, AH0 298 \u003d -1650 kJ / mol
Ilmassa alumiini on päällystetty erittäin vahvalla, ohuimmalla (10-8 m) oksidikalvolla, mikä heikentää jonkin verran alumiinin metallista kiiltoa. Oksidikalvon ansiosta alumiinipinta saa suuren korroosionkestävyyden. Tämä käy ilmi ensisijaisesti alumiinin välinpitämättömyydestä veden ja vesihöyryn suhteen. Suojakalvon muodostumisen vuoksi alumiini kestää tiivistettyjä typpi- ja rikkihappoja. Nämä hapot passivoivat alumiinia kylmässä. Passiivisuus taipumus parantaa alumiinin korroosionkestävyyttä käsittelemällä sen pintaa voimakkaalla hapettimella (esimerkiksi K2Cr2O7) tai käyttämällä anodista hapettumista. Tässä tapauksessa oksidikalvon paksuus nousee 3 - 10-5 m: iin. Korkeissa lämpötiloissa suojakalvon lujuus heikkenee voimakkaasti. Jos poistat oksidikalvon mekaanisesti, alumiinista tulee erittäin reaktiivinen. Se on vuorovaikutuksessa voimakkaasti veden ja happojen ja emästen vesipitoisten liuosten kanssa, syrjäyttäen vedyn ja muodostaen kationeja tai anioneja. Alumiinin vuorovaikutus happoliuosten kanssa etenee reaktioyhtälön mukaan
Al + 6H20 + 3H + \u003d [Al (H20) 6] 3 + + 0,5 H2
ja alkaliliuoksilla
Al + ZH20 + OH- \u003d [Al (OH) 4] - + 0,5 H2
Alumiinin kationit ja anionit siirtyvät helposti toisiinsa, kun liuoksen pH muuttuu:
[Al (H20) 6] 3+ + 4OH- \u003d [Al (OH) 4] - + 6H20
[Al (OH) 4] - + 4H + + 2H20 \u003d [Al (H20) 6] 3+
Sekoitetut yhdisteet voivat myös muodostaa liuokseen, esimerkiksi [Al (H20) 5 (OH)] 2+, [Al (H 2 O) 4 (OH) 2] +, [Al (H 2 O) 3 (OH) 3]. Jälkimmäinen dehydratoidaan helposti (erityisesti kuumennettaessa) ja muuttuu hydroksidiksi A1 (OH):
[Al (H20) 3 (OH) 3] \u003d Al (OH) 3 + CH20
Alumiinin laajin käyttö tekniikassa perustuu sen arvokkaisiin fysikaalisiin ja kemiallisiin ominaisuuksiin sekä sen korkeaan esiintyvyyteen maankuori. Korkean sähkönjohtavuuden (4 · 10–5 Ohm-1 · cm-1) ja pienen tiheyden vuoksi sitä käytetään sähköjohtojen valmistukseen. Alumiinin korkea taipuisuus mahdollistaa sen, että siitä tuotetaan ohuin folio, jota käytetään kondensaattoreissa ja korvataan kaapelikoteloissa alumiinilla. Ei magnetoitavuudesta johtuen alumiiniseoksia käytetään radiotekniikassa.
Suurin osa alumiinista käytetään kevyiden seosten tuotantoon - duralumiini (94% Al, loput Cu, Mg, Mn, Fe ja Si), silumiini (85–90% Al, 10–14% Si, loput Na) jne. Alumiinia käytetään, lisäksi seosten lisäaineena seosten lämmönkestävyyden aikaansaamiseksi. Alumiini ja sen seokset ovat yksi tärkeimmistä paikoista rakennusmateriaaleina lentokoneiden rakentamisessa, rakettien suunnittelussa, koneenrakennuksessa jne. Alumiinin (erityisesti eloksoidun) korroosionkestävyys ylittää huomattavasti teräksen korroosionkestävyyden. Siksi sen seoksia käytetään rakennemateriaaleina ja laivanrakennuksessa. D-elementtien kanssa alumiini muodostaa kemiallisia yhdisteitä - metalliyhdisteitä (aluminideja): NiAl, Ni3 Al, CoAl jne., Joita käytetään lämmönkestävinä materiaaleina. Alumiinia käytetään aluminotermisessä useiden metallien tuottamiseen ja termiittihitsaukseen. Aluminotermia perustuu alumiinin korkeaan affiniteettiin happea kohtaan. Esimerkiksi reaktiossa, joka etenee yhtälön mukaisesti
8Al + 3Fe3O4 \u003d 4Al2O3 + 9Fe
noin 3500 kJ lämpöä vapautuu ja lämpötila jopa 3000 ° C kehittyy.
Alumiinioksidia tunnetaan useissa muunnelmissa. Vakain on a-Al203. Tämä modifikaatio löytyy maankuoresta korundi-mineraalin muodossa, josta valmistetaan hiomalaikat ja hiomajauheet. Korundin käyttö hioma-aineena perustuu sen korkeaan kovuuteen, toiseksi vain timantin, SiC carborundumin ja BN-borazonin kovuuteen nähden. Al203: n fuusio Cr203: lla antaa keinotekoisia rubiineja. Tukikivet on valmistettu niistä täsmällisissä mekanismeissa. Viime aikoina keinotekoisia rubiineja käytetään kvanttigeneraattoreissa (lasereissa). Al2O3: n tuotteita käytetään tulenkestävänä ja dielektrisenä aineena.
Alumiinihydroksidi Al (OH) 3 on polymeeriyhdiste. Siinä on kerrostettu kidehila. Kukin kerros koostuu Al (OH) 6-oktaedrasta (kuva 1); kerrosten välillä toimii vety sidos. Vaihtoreaktiolla saatu alumiinihydroksidi on gelatiinimainen valkoinen sakka, joka liukenee helposti hapoihin ja emäksiin. Seistessä sakka “vanhentuu” ja menettää kemiallisen aktiivisuutensa. Kalsinoituna hydroksidi menettää vettä ja siirtyy Al2O3-oksidiksi. Yksi dehydratoidun hydroksidialumgeelin muodoista käytetään tekniikassa adsorbenttina.
Erityisen kiinnostavia ovat alumiiniyhdisteet - alumiinisilikaateihin liittyvät zeoliitit. Niiden koostumus voidaan ilmaista yleisella kaavalla Meh Oy O2y · nH2O, jossa Me - Ca tai Na (harvemmin Ba, Sr, K); E - Si ja Al muuttuvassa suhteessa. Zeoliittikiteissä on kanavia, joihin H20-molekyylit voivat tunkeutua.Tseoliittien vesipitoisuus vaihtelee suuresti vesihöyryn paineesta riippuen. Zeoliitit kykenevät vaihtamaan niiden sisältämän veden muihin nesteisiin (alkoholiin jne.). Kuumentamalla huolellisesti zeoliittien vesi poistuu vähitellen. Mutta edes täydellinen kuivuminen ei johda zeoliittikiteiden tuhoutumiseen. Kationit Ca2 + tai Na + zeoliiteissa muodostavat diffuusiokerroksen; niitä ei ole kiinnitetty kidehilaan, mutta veden kanssa ne sijaitsevat kiteen tyhjissä tiloissa. Tämä selittää teknisiin tarkoituksiin tärkeiden zeoliittien esiintymisen kationinvaihtoominaisuuksissa. Mahdollisuus korvata joitain kationeja toisilla sallii zeoliittien käytön ioninvaihtimina.
Lukuisia keinotekoisia zeoliiteja käytetään ns. Molekyyliseuloina. Jälkimmäisten kiteille on ominaista kapeiden kanavien läsnäolo, joiden halkaisija on 3-10-10 - 13-10-10 m. Molekyyliseulat absorboivat aineita, joiden molekyylit pääsevät näihin reikiin.
Esimerkiksi molekyyliseula, jonka reiän halkaisija on 3,5 x 10-10 m, voi absorboida H2, O2, N2-molekyylejä, mutta ei absorboida suurempia CH4- tai Ar-molekyylejä. Hiilivedyt voidaan erottaa molekyyliseulojen avulla, kuivata kaasut jne.
Gallium, indium ja tallium yksinkertaisten aineiden muodossa ovat sulavia hopeanvalkoisia metalleja. Ga: n, In: n ja Tl: n fysikaaliset ja kemialliset ominaisuudet eroavat huomattavasti Al: n ominaisuuksista huolimatta tarkasteltavien elementtien atomien ulkoisen energiatason elektronisen rakenteen samanlaisuudesta.
Tässä ilmeisesti Al-atomien ennalta energian tason elektronisen rakenteen ero vaikuttaa: (n-1) s2 (n-1) p6 ja toisaalta Ga, In ja Tl: n atomiin: (n-1) s2 (n- 1) p6 (n-1) d10.
Stabiilien yhdisteiden galliumin ja indiumin hapetustila on +3. Talliumille hapetustila + 1 on ominaisempi.Talliumyhdisteet, joissa metallin hapetustila on +3, ovat voimakkaita hapettimia.
Galliumilla on laaja lämpötila-alue nestemäisen tilan olemassaololle. Matala sulamispiste (noin 30 ° C), korkea kiehumispiste (2205 ° C) sallii nestemäisen galliumin käytön painemittarien valmistukseen.
Indium heijastaa tasaisesti kaiken pituisen valon aallot, joten sitä käytetään tarkkuusinstrumenteissa peilien valmistukseen. Lisäksi In on osa joihinkin matalalla sulavista seoksista.
Tallium lisätään myös joihinkin lejeerinkeihin, lähinnä tina- ja lyijyseoksiin (haponkestävät, laakerit).
Vedessä olevat oksidit Ga2O3, In2O3 ja Tl203 ovat käytännössä liukenemattomia. Emäksisten ominaisuuksien merkittävä lisääntyminen sarjassa Ga2O3 - In2O3 - Tl2O3 ilmenee oksidien lisääntyvästä liukoisuudesta happoihin.
Hydroksidit Ga (OH) 3, (OH) 3: ssa, Tl (OH) 3 vedessä ovat yhtä liukenemattomia kuin oksidit. Valkoinen sakka Ga (OH) 3 on yhtä liukoinen hapoihin ja emäksiin, ja puna-ruskea Tl (OH) 3 on liukoinen vain hapoihin.
Gallium ja indium muodostavat tyypin AIII BV binaarisia yhdisteitä jaksollisen järjestelmän ryhmän V p-elementtien kanssa (esimerkiksi GaP, GaAs, InSb jne.). Suurimmassa osassa tyypin AIII BV yhdisteitä sp3: n elektroniset kiertoradat hybridisoituvat; näiden yhdisteiden kidehilalla on rakenne, jolle on ominaista kemiallisten sidosten tetraedrinen järjestely. Monet näistä timanttimaisista yhdisteistä ovat puolijohteita. Niitä käytetään materiaalina vaihtovirran tasasuuntaajiin, antureihin, termoelektrisiin generaattoreihin jne.
Hiili, pii, germanium, tina ja lyijy muodostavat ryhmän IV pääryhmän. Ryhmän IV p-elementtien ulkoiset energiatasot sisältävät neljä elektronia (kokoonpano ns2np2), joista kaksi parillista s-elektronia ja kaksi paritonta p-elektronia.
Käyttämättömässä tilassa tämän alaryhmän elementeillä on kahden valenssi. Siirtyessä viritettyyn tilaan, jota seuraa yhden ulkoisen tason s-elektronien siirtyminen saman tason p-alatason vapaaseen soluun, kaikki ulkokerroksen elektronit muuttuvat pareittain, ja valenssi tässä tapauksessa kasvaa 4: ään.
Rikillä, seleenillä, telluurilla ja poloniumilla on myös 6 elektronia ulkoisella tasolla (s.)2 p 4 ), mutta heillä kaikilla on täyttämätön d-taso, joten heillä voi olla jopa 6 paritonta elektronia ja niiden yhdisteiden hapetustilat ovat 2, +4 ja +6.
Näiden elementtien aktiivisuuden muutoskuvio on sama kuin halogeeniryhmässä: telluridit, sitten selenidit ja sulfidit, hapettuvat helpoimmin. Happirikkiyhdisteistä rikki (VI) yhdisteet ovat vakaimpia ja telluuri (IV) yhdisteet ovat vakaimpia. Seleeniyhdisteet vievät väliaseman.
D-taso on täytetty kromialaryhmän elementeissä, siksi niiden atomien s-tasolla - 1 kpl (kromi ja molybdeeni) tai 2 (volframi) elektroni. He kaikki näyttelevät suurin aste hapetus on +6, mutta molybdeenille ja erityisesti kromille yhdisteet ovat ominaisia, joissa niiden alhaisempi hapetustila (+4 molybdeenille ja +3 tai +2 kromille). Kromi (III) -yhdisteet ovat erittäin stabiileja ja samanlaisia \u200b\u200bkuin alumiiniyhdisteet.
Kaikkia kromi-alaryhmän metalleja käytetään laajasti.
Molybdeenin hankki ensimmäisen kerran K. V. Scheele vuonna 1778. Sitä käytetään korkean lujuuden ja lujuuden omaavien terästen valmistukseen, jota käytetään aseputkien, panssaroiden, akseleiden jne. Valmistukseen.
Koska kyky haihtua korkeassa lämpötilassa, se ei ole kovin sopiva filamenttien valmistukseen, mutta sillä on hyvä kyky sulautua lasiin, minkä vuoksi sitä käytetään hehkulamppujen volframilankojen pidikkeiden valmistukseen.
K. V. Scheele löysi myös volframin vuonna 1781. Sitä käytetään erikoisterästen valmistukseen. Volframin lisääminen teräkseen lisää sen kovuutta, joustavuutta ja lujuutta. Yhdessä kromin kanssa volframi antaa teräkselle kyvyn ylläpitää kovuutta erittäin korkeissa lämpötiloissa, minkä vuoksi tällaisia \u200b\u200bteräksiä käytetään nopeiden sorvauskoneiden leikkureiden valmistukseen.
Puhtaalla volframilla on korkein sulamispiste metalleissa (3370 astetta C), joten sitä käytetään hehkulamppujen hehkulankojen valmistukseen. Volframikarbidilla on erittäin korkea kovuus ja lämmönkestävyys ja se on tulenkestävien seosten pääkomponentti.
Typpityöryhmä koostuu viidestä elementistä: typestä, fosforista, arseenista, antimonista ja vismutista. Nämä ovat p-elementtejä D. I. Mendelejevin jaksollisen järjestelmän V-ryhmästäUlkoisella energiatasolla näiden elementtien atomit sisältävät viisi elektronia, joiden konfiguraatio on ns2np3 ja jakautuvat seuraavasti:
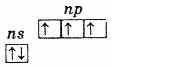
Siksi näiden elementtien suurin hapetustila on +5, alin on -3 ja + 3 on myös ominaista. Kolmen parittoman elektronin läsnäolo ulkoisella tasolla osoittaa, että käyttämättömässä tilassa elementtien atomilla on valenssi 3. Typpiatomin ulkoinen taso koostuu vain kahdesta alitasosta - 2 ja 2r. Tämän alaryhmän jäljellä olevien elementtien atomilla ulkoisilla energiatasoilla on tyhjiä d-alatason soluja. Siksi yksi ulkoisen tason s-elektroneista voi herätessä siirtyä saman tason d-alatasoon, mikä johtaa 5 parittoman elektronin muodostumiseen.
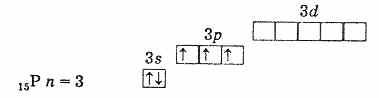
fosforin (käyttämätön atomi) ulkoinen elektronikuori
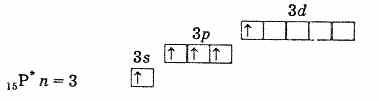
viritetyn fosforiatomin ulommassa elektronikuoressa. Näin ollen viritetyssä tilassa olevalla fosforilla, arseenilla, antimonilla ja vismutilla on 5 parittomia elektroneja, ja niiden valenssi tässä tilassa on 5. Typpiatomissa elektronia ei voida virrata tällä tavoin, koska toisella tasolla ei ole d-alatasoa. Tämän seurauksena typpi ei voi olla viisiarvoinen, mutta se voi muodostaa neljännen kovalenttisen sidoksen luovuttaja-vastaanottajamekanismista johtuen yksinäisestä elektroniparista 2s2. Typpiatomille toinen menetelmä on mahdollinen. Kun toinen kahdesta 2s-elektronista irtoaa, typpi kulkee yksin varautuneena tetravalenttisena ionina N +.

Typistä vismuttiin atomien säteet kasvavat ja ionisaatiopotentiaalit vähenevät. Neutraalien atomien pelkistävät ominaisuudet paranevat N: stä Bi: ksi, kun taas hapettavat ominaisuudet heikentyvät (katso taulukko 21).
Vedyn, typen, fosforin ja arseenin kanssa muodostavat polaariset yhdisteet RH3, ja niiden negatiivinen hapetustila on -3. RH3-molekyylit ovat pyramidimuotoisia. Näissä yhdisteissä elementtien sidokset vedyn kanssa ovat vahvempia kuin vastaavissa happea alaryhmän ja erityisesti halogeenin alaryhmän alkuaineiden yhdisteissä. siksi vetyyhdisteet typen alaryhmän elementit vesiliuokset eivät muodosta vetyioneja.
Hapen kanssa typpiryhmän elementit muodostavat oksideja, joilla on yleiset kaavat R2O3 ja R2O5. Oksidit vastaavat hapot HRO2 ja HRO3 (ja H3RO4 ortohapot, paitsi typpi). Alaryhmässä oksidien luonne muuttuu seuraavasti: N2O3 - happooksidi; P4O6 - heikosti hapanoksidi; As2O3 - amfoteerinen oksidi joilla on pääosin happamat ominaisuudet; Sb2O3 on amfoteerinen oksidi, jolla on pääasiassa emäksisiä ominaisuuksia; Bi2O3 on pääoksidi. Siten koostumuksen R2O3 ja R2O5 oksidien happamat ominaisuudet vähenevät elementtien sarjanumeron kasvaessa, kuten taulukosta voidaan nähdä. Kuten kuviosta 21 ilmenee, ei-metalliset ominaisuudet vähenevät alaryhmässä typestä vismuttiin ja metalliset ominaisuudet lisääntyvät. Antimonissa nämä ominaisuudet ilmaistaan \u200b\u200bsamalla tavalla, vismutissa, metallit ovat pääosin, typessä, ei-metalliset. Fosfori, arseeni ja antimoni muodostavat useita allotrooppisia yhdisteitä.
Jaksollisen elementtijärjestelmän kuudes ryhmä koostuu kahdesta alaryhmästä: pääosa - happi, rikki, seleeni, telluuri ja polonium - ja sivu - kromi, molybdeeni ja volframi. Pääryhmässä erotellaan seleenin alaryhmä (seleeni, telluuri ja polonium), sivualaryhmää kutsutaan kromin alaryhmäksi. Kaikki pääryhmän elementit, happea lukuun ottamatta, voivat kiinnittää kaksi elektronia muodostaen elektronegatiivisia ioneja.
Pääryhmän elementeillä on kuusi elektronia ulkoisella elektronisella tasolla (s2p4). Happiatomeissa on kaksi parittomia elektroneja ja niillä ei ole d-tasoa. Siksi happi osoittaa pääasiassa hapettumisastetta (2 ja vain yhdisteissä, joissa on fluori +2. Rikkilla, seleenillä, telluurilla ja poloniumilla on myös kuusi elektronia ulkoisella tasolla (s2p4), mutta kaikilla niistä on täyttämätön d-taso, joten ne voivat joilla on korkeintaan kuusi paritonta elektronia ja joilla on hapetustila yhdisteissä - 2, +4 ja +6.
Näiden elementtien aktiivisuuden muutoskuvio on sama kuin halogeeniryhmässä: telluridit, sitten selenidit ja sulfidit, hapettuvat helpoimmin. Happirikkiyhdisteistä rikki (VI) yhdisteet ovat vakaimpia ja telluuri (IV) yhdisteet ovat vakaimpia. Seleeniyhdisteet vievät väliaseman.
Seleenillä ja telluurilla sekä niiden yhdisteillä tiettyjen metallien (indium, talliumi jne.) Kanssa on puolijohdeominaisuuksia ja niitä käytetään laajasti radioelektroniikassa. Seleeni- ja telluuriyhdisteet ovat erittäin myrkyllisiä. Niitä käytetään lasiteollisuudessa värillisten (punaisten ja ruskeiden) lasien valmistukseen.
D-taso täytetään kromin alaryhmän elementeissä, siksi niiden atomien s-tasolla - yksi kerrallaan (kromille ja molybdeenille) tai kaksi (volframi) elektronia. Siinä kaikki on, että niiden suurin hapetustila on +6, mutta molybdeenille ja erityisesti kromille on tunnusomaista yhdisteet, joissa niiden alhaisempi hapetustila (+4 molybdeenille ja +3 tai +2 kromille). Kromi (III) -yhdisteet ovat erittäin stabiileja ja samanlaisia \u200b\u200bkuin alumiiniyhdisteet. Kaikkia kromi-alaryhmän metalleja käytetään laajasti.
Molybdeenin hankki ensin K. V. Scheele vuonna 1778. Sitä käytetään erittäin lujien ja sitkeiden terästen valmistukseen, joita käytetään aseiden tynnyreiden, haarniskoiden, akseleiden jne. Valmistukseen. Koska se kykenee haihtumaan korkeassa lämpötilassa, siitä on vähän hyötyä filamenttien valmistuksessa. , mutta sillä on hyvä kyky sulautua lasiin, joten sitä käytetään hehkulamppujen volframilankojen pidikkeiden valmistukseen.
K. V. Scheele löysi myös volframin vuonna 178! d. Sitä käytetään erityisten terästen valmistukseen. Volframin lisääminen teräkseen lisää sen kovuutta, joustavuutta ja lujuutta. Yhdessä kromin kanssa volframi antaa teräkselle kyvyn ylläpitää kovuutta erittäin korkeissa lämpötiloissa, minkä vuoksi tällaisia \u200b\u200bteräksiä käytetään nopeiden sorvauskoneiden leikkureiden valmistukseen. Puhtaalla volframilla on korkein sulamispiste metalleissa (3370 (C)), joten sitä käytetään hehkulamppujen hehkulankojen valmistukseen. Volframikarbidi on erittäin kova ja lämmönkestävä ja se on tulenkestävien seosten pääkomponentti.
Jaksollisen järjestelmän VII ryhmän elementit on jaettu kahteen alaryhmään: pääosa - halogeenien alaryhmä - ja toissijainen - mangaanin alaryhmä. Vety sijoitetaan myös samaan ryhmään, vaikka sen atomilla on ulkoinen valenssitaso, siinä on yksi elektroni ja se tulisi sijoittaa ryhmään I.
Vetyllä on kuitenkin hyvin vähän yhteistä sekä alaryhmän peruselementeissä - alkalimetallien että sekundaarisen alaryhmän - kuparin, hopean ja kullan kanssa. Samanaikaisesti se, kuten halogeenit, liittyi elektroniin reaktioissa aktiivisten metallien kanssa muodostaen hydridejä, joilla on jonkin verran samankaltaisuutta halogenidien kanssa.
Halogeenin alaryhmään kuuluvat fluori, kloori, bromi, jodi ja astatiini. Ensimmäiset 4 alkuainetta löytyy luonnosta, jälkimmäistä saadaan keinotekoisesti, ja sen vuoksi sitä tutkitaan paljon vähemmän kuin muita halogeeneja. Sana "halogeeni" tarkoittaa suolan muodostamista. Alaryhmän elementit saivat tämän nimen, koska ne reagoivat helposti monien metallien kanssa muodostaen suoloja.
Kaikilla halogeeneilla on ulkoinen elektronikuorirakenne s2 p 5 . Siksi ne hyväksyvät helposti elektronin, muodostaen stabiilin jalokaasuelektronikuoren (-kuoret)2 s. 6 ). Alaryhmän atomin pienin säde on fluori, lopussa se kasvaa järjestyksessä F< Cl < Br < I < Аt и составляет соответственно 133; 181; 196; 220 и 270 нм. В таком же порядке уменьшается сродство атомов элементов к электрону.
halogeenit - erittäin aktiiviset elementit. Ne voivat poistaa elektroneja paitsi atomeista, jotka antavat ne helposti pois, vaan myös ioneista ja jopa syrjäyttää muut vähemmän aktiiviset halogeenit yhdisteistään. Esimerkiksi fluori syrjäyttää kloorin klorideista, bromin bromideista ja jodin jodideista.
Kaikista halogeeneistä vain jaksolla II olevalla fluorilla ei ole täyttämätöntä d-tasoa. Tästä syystä siinä voi olla vain yksi parittomat elektronit ja sen valenssi on vain -1. Muiden halogeenien atomeissa d-taso ei ole täyttynyt, mikä mahdollistaa niiden erilaisen lukumäärän parittomien elektronien määrän ja niiden valenssien -1, +1, +3, +5 ja +7, jotka havaitaan kloorin, bromin ja jodin happiyhdisteissä.
Mangaanin alaryhmään kuuluvat mangaani, teknetium ja renium. Toisin kuin halogeenit, mangaanin alaryhmän elementeillä on vain 2 elektronia ulkoisella elektronisella tasolla ja siksi ne eivät osoita kykyä kiinnittää elektronia muodostaen negatiivisesti varautuneita ioneja.
Mangaani on luonnossa yleistä ja sitä käytetään laajasti teollisuudessa.
Teknetium on radioaktiivinen, emme tapaa luonnossa, mutta sitä saadaan keinotekoisesti (ensimmäistä kertaa - E. Segre ja K. Perrier, 1937) .Tämä elementti muodostuu uraanin radioaktiivisen hajoamisen takia. Rhenium on yksi hajallaan olevista elementeistä. Se ei muodosta itsenäisiä mineraaleja, mutta se löytyy tiettyjen mineraalien, erityisesti molybdeenin, satelliitista.
Sen löysivät V. ja I. Noddak vuonna 1925. Seoksilla, joissa on pieniä reenilisäaineita, on lisääntynyt korroosionkestävyys. Rheniumin lisääminen seoksiin lisää niiden mekaanista lujuutta.
Tämän reeniumin ominaisuuden ansiosta sitä voidaan käyttää iridiumin jalometallin sijasta. Platina-platina-reeni-lämpöparit toimivat paremmin kuin platina-platina-iridium-parit, mutta niitä ei voida käyttää erittäin korkeissa lämpötiloissa, koska haihtuva yhdiste Re2 O 7.
Jaksollisen järjestelmän kahdeksannen ryhmän pääryhmä on jalokaasut -helium, neon, argon, krypton, ksenonija radoni. Näille elementeille on ominaista erittäin alhainen kemiallinen aktiivisuus, mikä antoi syyn kutsua niitä jaloiksi tai inertteiksi kaasuiksi. Ne muodostavat yhdisteitä vain vaikeuksissa olevien muiden alkuaineiden tai aineiden kanssa; heliumin, neonin ja argonin kemiallisia yhdisteitä ei saatu. Jalokaasujen atomit eivät ole yhteydessä molekyyleihin, toisin sanoen niiden molekyylit ovat monatomisia.
Jalokaasut suorittavat jokaisen elementtijärjestelmän jakson. Heliumin lisäksi kaikissa heillä on kahdeksan elektronia atomin ulkoisessa elektronikerroksessa, jotka muodostavat erittäin vakaan järjestelmän. Kaksi elektronia sisältävä heliumin elektronikuori on myös vakaa. Siksi jalokaasujen atomeille on ominaista korkea ionisaatioenergia ja yleensä elektroniaffiniteetin negatiiviset arvot.
Pitkä aika uskottiin, että jalokaasujen atomit eivät yleensä kykene muodostamaan kemiallisia sidoksia muiden elementtien atomien kanssa. Ainoa suhteellisen epästabiileja jalokaasujen molekyyliyhdisteitä - esimerkiksi hydraatteja - tunnettiin
Ar-6H20, Kg-6H20, Xe-6H2 0, joka muodostuu puristettujen jalokaasujen vaikutuksesta kiteytettyyn superjäähdytettyyn veteen. Nämä hydraatit kuuluvat klatraattityyppiin; valenssisidoksia ei muodostu tällaisten yhdisteiden muodostuessa. Klatraattien muodostumista veden kanssa suosii lukuisten onteloiden esiintyminen jään kiderakenteessa.
Viime vuosikymmeninä on kuitenkin havaittu, että kryptoni, ksenoni ja radoni kykenevät liittymään muihin alkuaineisiin ja ennen kaikkea fluoria. niin; jalokaasujen välittömässä vuorovaikutuksessa fluorin kanssa (kuumennettaessa tai sähköpurkautettaessa) saadaan fluoridejaKrF2, XeF2, KrF4, XeF4 ja RnF4 . Ne kaikki ovat kiteitä, jotka ovat stabiileja normaaleissa olosuhteissa. Saatiin myös ksenonin johdannaisia \u200b\u200bhapetustilassa; +6 - heksafluoridiXeF 6 , Xe03-trioksidi, Xe (OH) hydroksidi b. Kaksi viimeistä yhdistettä osoittavat happamia ominaisuuksia; joten reagoidessaan emästen kanssa ne muodostavat suolojaksenonihappo,esimerkiksi: Xe03 + Ba (OH) 2 - BaXe04 + H20.
johdannaiset; ksenoni (VI) - voimakkaasti hapettavat aineet. Vielä voimakkaampien hapettimien vaikutuksesta voidaan kuitenkin saada yhdisteitä, joissa ksenonin hapetustila on -4-8. Oktafluoridi tunnetaan sellaisista yhdisteistä.XeF 8, Xe0 tetraoksidi 4 ja oksoheksafluoridiXeOF 6.
Kryptonin, ksenonin ja radonin korkeampi kemiallinen aktiivisuus verrattuna jaloryhmän ensimmäisiin jäseniin; kaasut selittyvät niiden atomien suhteellisen alhaisilla ionisaatiopotentiaaleilla. Kryptonin, ksenonin ja radonin osalta nämä arvot ovat lähellä joidenkin muiden elementtien ionisaatiopotentiaaleja (esimerkiksi typpiatomin ionisaatiopotentiaali on 14,53in, klooriatomi - 12,97 V).
Argonilla, neonilla ja heliumilla on suurin käytännöllinen sovellus.
Vety (lat. Hydrogenium), H, kemiallinen alkuaine, ensin sarjanumero Mendelejevin kausijärjestelmässä; atomimassa 1.0079. Tavallisissa olosuhteissa vety on kaasu; Sillä ei ole väriä, hajua ja makua.
Historiallinen tausta. XVI ja XVII vuosisatojen kemistien kirjoituksissa on toistuvasti mainittu palavan kaasun vapautumista happojen vaikutuksesta metalleihin. Vuonna 1766 G. Cavendish keräsi ja tutki kehittynyttä kaasua kutsuen sitä "palavaksi ilmaan". Phlogiston-teorian kannattaja Cavendish uskoi, että tämä kaasu oli puhdasta phlogistonia. Vuonna 1783 A. Lavoisier osoitti veden analysoimalla ja syntetisoimalla sen koostumuksen monimutkaisuuden, ja vuonna 1787 hän määritteli "palavan ilman" uudeksi kemialliseksi alkuaineeksi (vety) ja antoi sille nykyaikaisen nimen vety (kreikkalaisesta vedestä - vesi ja gennao - synnytin), mikä tarkoittaa "veden synnyttämistä"; tätä juuria käytetään vetyyhdisteiden nimissä ja prosesseissa sen mukana (esimerkiksi hydridit, hydraus). nykyaikainen venäjän nimi MF Soloviev ehdotti "vetyä" vuonna 1824.
Vedyn jakautuminen luonnossa. Vety on levinnyt luonnossa laajalti, sen pitoisuus maankuoressa (litosfääri ja hydrosfääri) on 1 massaprosentti ja 16% atomien lukumäärästä. Vety on osa maapallon runsaimpia aineita - vettä (11,19 painoprosenttia vetyä), yhdisteitä, jotka muodostavat hiiltä, \u200b\u200böljyä, luonnonkaasuja, savia sekä eläinten ja kasvien organismeja (ts. Proteiineja, nukleiinihappoja) , rasvat, hiilihydraatit ja muut). Vety on vapaassa tilassaan erittäin harvinainen, pieninä määrinä sitä löytyy vulkaanisista ja muista luonnonkaasuista. Ilmakehässä on pieniä määriä vapaata vetyä (0,0001% atomien lukumäärästä). Maan lähellä olevassa tilassa protonivuon muodossa oleva vety muodostaa maan sisäisen (”protonin”) säteilyvyön. Avaruudessa vety on yleisin alkuaine. Plasmamuodossa se muodostaa noin puolet auringon ja useimpien tähteiden massasta, suurimman osan tähteiden välisen väliaineen kaasuista ja kaasumousuista. Vetyä on läsnä useiden planeettojen ilmakehässä ja komeeteissa vapaan H: n muodossa2, metaani CH4, ammoniakki NH3, vesi H2 Voi, radikaalit, kuten CH, NH, OH, SiH, PH, jne. Protonivuon muodossa vety on osa auringon ja kosmisten säteiden säteilyn säteilyä.
Isotoopit, atomi ja vetymolekyyli. Tavallinen vety koostuu seoksesta, joka koostuu kahdesta stabiilista isotoopista: kevyestä vedystä tai protiumista (1 H) ja raskas vety tai deuterium (2 H tai D). Luonnollisissa vetyyhdisteissä atomia kohti2 H: n osuus on keskimäärin 6800 atomia1 H. Radioaktiivista isotooppia, jonka massa on 3, kutsutaan superheavy vedyksi tai tritiumiksi (3 H tai T), pehmeällä β-säteilyllä ja puoliintumisajalla T½ \u003d 12,262 vuotta. Luonnossa tritium muodostuu esimerkiksi ilmakehän typestä kosmisen säteen neutronien vaikutuksen alaisena; ilmakehässä se on vähäinen (4,10%)-15 % vetyatomien kokonaismäärästä). Saatu erittäin epävakaa isotooppi4 H. Isotooppien massamäärät1 N, 2 N, 3 N ja 4 H, vastaavasti 1, 2, 3 ja 4, osoittavat, että protiumatomin ydin sisältää vain yhden protonin, deuterium - yhden protonin ja yhden neutronin, tritium - yhden protonin ja 2 neutronin,4 H - yksi protoni ja 3 neutronia. Vetyisotooppien suuri ero aiheuttaa niiden fysikaalisissa ja kemiallisissa ominaisuuksissa huomattavamman eron kuin muiden alkuaineiden isotooppien tapauksessa.
Vetyatomilla on yksinkertaisin rakenne kaikkien muiden elementtien atomien joukossa: se koostuu ytimestä ja yhdestä elektronista. Elektronin sitoutumisenergia ytimen kanssa (ionisaatiopotentiaali) on 13,595 eV. Neutraali atomi Vety voi myös kiinnittää toisen elektronin, muodostaen negatiivisen ionin H- toisen elektronin sitoutumisenergia neutraalin atomin kanssa (elektroniaffiniteetti) on 0,78 eV. Kvanttimekaniikka antaa meille mahdollisuuden laskea vetyatomin kaikki mahdolliset energiatasot ja antaa sen vuoksi täydellisen tulkinnan sen atomispektristä. Vetyatomia käytetään mallina kvanttimekaanisissa laskelmissa muiden, monimutkaisempien atomien energiatasoista.
Molecule Hydrogen N2 koostuu kahdesta atomista, jotka on kytketty kovalenttisesti kemiallinen sidos. Hajoamisen (ts. Hajoamisen atomiksi) energia on 4,776 eV. Ytimien välinen etäisyys ytimien tasapainotilassa on 0,7414 Å. Korkeissa lämpötiloissa molekyylivety dissosioituu atomiksi (dissosiaatioaste 2000 ° C: ssa on 0,0013, 5000 ° C: ssa 0,95). Atomivetyä muodostuu myös erilaisina kemialliset reaktiot (esimerkiksi Zn: n vaikutuksella suolahappoon). Vedyn olemassaolo atomitilassa kestää kuitenkin vain lyhyen ajan, atomit rekombinoituvat H-molekyyleiksi2 .
Vedyn fysikaaliset ominaisuudet. Vety on kevyin kaikista tunnetuista aineista (14,4 kertaa kevyempi kuin ilma), tiheys 0,0899 g / l 0 ° C: ssa ja 1 atm. Vety kiehuu (nesteytyy) ja sulaa (kovettuu) lämpötiloissa -252,8 ° C ja -259,1 ° С (vain heliumilla on enemmän alhaiset lämpötilat sulaminen ja kiehuminen). Vedyn kriittinen lämpötila on erittäin matala (-240 ° C), joten sen nesteytymiseen liittyy suuria vaikeuksia; kriittinen paine 12,8 kgf / cm2 (12,8 atm), kriittinen tiheys 0,0312 g / cm3 . Kaikista kaasuista vedyllä on suurin lämmönjohtavuus, yhtä suuri kuin 0 ° C ja 1 atm 0,174 W / (m · K), eli 4,16 · 10-4 cal / (s · cm · ° C). Ominaislämpö Vety 0 ° C: n ja 1 atm: n lämpötilassap 14,208 kJ / (kg-K), ts. 3,394 cal / (g ° C). Vety liukenee veteen heikosti (0,0182 ml / g lämpötilassa 20 ° C ja 1 atm), mutta hyvä monissa metalleissa (Ni, Pt, Pa ja muut), erityisesti palladiumissa (850 tilavuutta / 1 tilavuusosa Pd: tä). Vedyn liukoisuus metalleihin liittyy sen kykyyn diffundoida niiden läpi; diffuusioon hiileseoksen (esim. teräksen) läpi liittyy joskus lejeeringin tuhoutuminen vedyn ja hiilen vuorovaikutuksesta johtuvan vaikutuksen vuoksi (ns. hiilenpoisto). Nestemäinen vety on erittäin kevyt (tiheys -253 ° C: ssa 0,0708 g / cm)3 ) ja virtaava (viskositeetti -253 ° C: n lämpötilassa 13,8: a).
Vedyn kemialliset ominaisuudet. Useimmissa yhdisteissä vedyllä on valenssi (tarkemmin hapetustila) +1, kuten natriumilla ja muilla alkalimetalleilla; yleensä sitä pidetään näiden metallien analogina, joka johtaa Mendeleev-järjestelmän ensimmäistä ryhmää. Metallihydrideissä vetyioni on kuitenkin negatiivisesti varautunut (hapetustila -1), ts. Na-hydridi+ H - rakennettu kuten Na-kloridi+ Cl - . Tämä ja jotkut muut tosiasiat (läheisyys fysikaaliset ominaisuudet Vety ja halogeenit, halogeenien kyky korvata vety orgaanisissa yhdisteissä) antaa syyn luokitella vety jaksollisen järjestelmän ryhmään VII. Tavanomaisissa olosuhteissa molekyylivety on suhteellisen vähän aktiivinen, yhdistäen suoraan vain aktiivisimpiin ei-metalleihin (fluorin kanssa ja valossa kloorin kanssa). Kuumennettuna se reagoi kuitenkin monien elementtien kanssa. Atomivety on lisännyt kemiallista aktiivisuutta verrattuna molekyylin aktiivisuuteen. Hapen kanssa vety muodostaa veden:
H2 + 1/2 O 2 \u003d H20
vapauttamalla 285,937 kJ / mol, ts. 68,3174 kcal / mol lämpöä (lämpötilassa 25 ° C ja 1 atm). Normaalilämpötiloissa reaktio etenee erittäin hitaasti, yli 550 ° C - räjähdyksellä. Vety-happiseoksen räjähdysrajat ovat (tilavuutena) 4 - 94% N2 ja vety-ilmaseos 4 - 74% N2 (seos, jossa on 2 tilavuutta N2 ja 1 tilavuusosa 02: ta nimeltään räjähtävä kaasu). Vetyä käytetään monien metallien pelkistämiseen, koska se vie happea niiden oksideista:
CuO + H2 \u003d Cu + H20,
Fe3O4 + 4H2 \u003d 3Fe + 4H20 jne.
Halogeenien kanssa Vety muodostaa vetyhalogenideja, esimerkiksi:
H2 + Cl2 \u003d 2CHl.
Samaan aikaan vety räjähtää fluorin kanssa (jopa pimeässä ja -252 ° C: ssa), reagoi kloorin ja bromin kanssa vain valaistuna tai lämmitettäessä ja jodin kanssa vain kuumennettaessa. Vety on vuorovaikutuksessa typen kanssa muodostaen ammoniakkia:
ZN2 + N2 \u003d 2NH3
vain katalysaattorissa ja korotetuissa lämpötiloissa ja paineissa. Kuumennettaessa vety reagoi voimakkaasti rikin kanssa:
H2 + S \u003d H2S (rikkivety),
paljon vaikeampaa seleenin ja telluurin kanssa. Puhtaalla hiilellä vety voi reagoida ilman katalyyttiä vain korkeissa lämpötiloissa:
2H2 + C (amorfinen) \u003d CH4 (metaani).
Vety reagoi suoraan joidenkin metallien (alkalinen, maa-alkalimetalli ja muut) kanssa, muodostaen hydridejä:
H2 + 2Li \u003d 2LiH.
Suuri käytännön merkitys on vedyn reaktioilla hiilimonoksidin (II) kanssa, joissa muodostuu erilaisia \u200b\u200borgaanisia yhdisteitä lämpötilasta, paineesta ja katalyytistä riippuen, esimerkiksi HCNO, CH3 HE ja muut. Tyydyttymättömät hiilivedyt reagoivat vedyn kanssa muuttuen tyydyttyneiksi, esimerkiksi:
CnH2n + H2 \u003d CnH2n + 2.
Vedyn ja sen yhdisteiden rooli kemiassa on poikkeuksellisen suuri. Vety määrää ns. Proottisten happojen happamia ominaisuuksia. Vetyllä on taipumus muodostaa ns. Vety sidos tiettyjen elementtien kanssa, jolla on ratkaiseva vaikutus monien orgaanisten ja epäorgaanisten yhdisteiden ominaisuuksiin.
Vetyä. Tärkeimmät raaka - aineiden tyypit teollinen kuitti Vety - luonnolliset palavat kaasut, koksiuunin ja öljyn puhdistuskaasut. Vetyä saadaan myös vedestä elektrolyysillä (paikoissa, joissa on halpaa sähköä). Tärkeimmät tavat Vetytuotanto maakaasu ovat hiilivetyjen, pääasiassa metaanin, katalyyttistä vuorovaikutusta vesihöyryn kanssa (muuntaminen):
CH4 + H20 \u003d CO + 3H2,
ja hiilivetyjen epätäydellinen hapetus hapella:
CH4 + 1/2 O2 \u003d CO + 2H2
Tuloksena oleva hiilimonoksidi (II) myös muutetaan:
СО + Н 2 О \u003d СО 2 + Н 2.
Maakaasusta uutettu vety on halvin.
Vety eristetään koksiuunin ja öljyn puhdistuskaasuista poistamalla kaasuseoksen jäljellä olevat komponentit, nesteytetty helpommin kuin vety, syväjäähdytyksellä. Vesi elektrolysoidaan tasavirralla johtamalla se KOH: n tai NaOH-liuoksen läpi (happoja ei käytetä teräslaitteiden korroosion välttämiseksi). Laboratorioissa vetyä saadaan veden elektrolyysillä sekä sinkin ja suolahapon välisellä reaktiolla. He käyttävät kuitenkin usein valmistettua tehdasvetyä sylintereissä.
Vedyn käyttö. Teollisessa mittakaavassa vetyä saatiin 1700-luvun lopulla pallojen täyttämiseksi. Vetyä käytetään tällä hetkellä laajalti kemianteollisuudessa, pääasiassa ammoniakin tuotantoon. Suuri vedyn kuluttaja on myös metyyli- ja muiden alkoholien, synteettisen bensiinin ja muiden tuotteiden, jotka on saatu synteesillä vetyä ja hiilimonoksidia (II), tuotanto. Vetyä käytetään kiinteiden ja raskaiden nestemäisten polttoaineiden, rasvojen ja muiden hydraamiseen, HCl: n synteesiin, öljytuotteiden vetykäsittelyyn, metallien hitsaamiseen ja leikkaamiseen happivety liekillä (lämpötila enintään 2800 ° C) ja atomi-vetyhitsaukseen (jopa 4000 ° C). . Vetyisotoopit - deuterium ja tritium - ovat löytäneet erittäin tärkeitä sovelluksia ydinenergiassa.
Alkuaineiden kemialliset ominaisuudet Sivu 13
Kemia on tiede, joka tutkii kemiallisia alkuaineita, niiden muodostamia yksinkertaisia \u200b\u200bja monimutkaisia \u200b\u200baineita (koostumus, rakenne, ominaisuudet), niiden muunnoksia ja lakeja, joita nämä muutokset noudattavat. Se on jaettu epäorgaanisiin, orgaanisiin, fysikaalisiin, analyyttisiin, kolloidisiin jne. Nykyaikainen kemia liitetään muihin tieteisiin, mikä johtaa tieteen raja-alueiden syntyyn: biokemia, agrokemia, kosmokemia, radiokemia jne. Nykyaikaisen kemian saavutukset ovat kannustin kemianteollisuuden intensiiviselle kasvulle, he pelaavat. tärkeä rooli kansantalouden kaikkien alojen tieteellisessä ja teknologisessa kehityksessä. Kemialla on tärkeä tehtävä ratkaistaessa nykyajan yhteiskunnan kiireellisimpiä ja lupaavimpia ongelmia (tehostelannoitteiden tehokkuuden ja turvallisuuden lisääminen maatalouden tuottavuuden lisäämiseksi ja elintarvikkeiden syntetisoinnin ongelma muista kuin ruokaraaka-aineista; valtamerten raaka-aineiden lähteiden kehittäminen; uusien energialähteiden kehittäminen ja luominen; uusien aineiden synteesi) tulevaisuuden ongelmien ratkaisemiseksi tarvittavat sävellykset; ympäristö). Katso nro 2, s334.
Kemian tutkimuksen kohteena ovat kemialliset elementit ja niiden yhdisteet. Kemiallinen elementti on joukko atomeja, joilla on sama ydinvaraus. Atomi on puolestaan \u200b\u200bkemiallisen alkuaineen pienin hiukkanen, joka säilyttää kaikki sen kemialliset ominaisuudet. Siten kukin kemiallinen elementti vastaa tietyn tyyppistä atomia. Katso numero 3, s. 11.
Molekyyli on yksittäisen aineen pienin partikkeli, joka kykenee itsenäiseen olemassaoloon, jolla on sen kemialliset perusominaisuudet ja joka koostuu samoista tai eri atomeista. Molekyylit voivat olla mono-, di- ja polyatomisia. Ne ovat aineen hiukkasia. Jos molekyylit koostuvat samoista atomeista, niin ainetta kutsutaan yksinkertaiseksi tai alkuaineeksi, esimerkiksi He, Ar, H2, O2, O3, S4, P4. Yksinkertainen aine on muoto kemiallisen elementin olemassaolosta vapaassa tilassa. Katso numero 3, c11 s12.
Jos aineen molekyyli koostuu eri atomeista, niin ainetta kutsutaan kompleksiksi (tai kemiallinen yhdiste), esimerkiksi CO, H20, NH3, H3PO4. Kaikille aineille on ominaista tietty koostumus (molekyylin atomien luonne ja lukumäärä), rakenne ( alueellinen järjestely molekyylin atomit) ja tietyt fysikaaliset ja kemialliset ominaisuudet. Katso numero 3, s. 12.
Aineen kemialliset ominaisuudet kuvaavat sen kykyä osallistua kemiallisiin reaktioihin, toisin sanoen joidenkin aineiden muutosprosesseihin toisiksi. Näiden ominaisuuksien ymmärtämiseksi on välttämätöntä tuntea aineiden koostumus ja rakenne. Katso numero 3, s. 12.
Koko jaksotaulukko voidaan jakaa metalleihin, ei-metalleihin ja amfoteerisiin aineisiin. metallit - yksinkertaiset aineet, joille on tunnusomaista kyky luovuttaa ulkoisella energiatasolla sijaitsevia elektroneja (valenssielektroneja) ja siirtyä positiivisesti varautuneisiin ioneihin. Lähes kaikilla metalleilla on korkea sähkön- ja lämmönjohtavuus, kyky heijastaa valoaaltoja hyvin (mikä määrittelee niiden kiillon ja opasiteetin) ja taipuisuus. Kiinteässä tilassa niillä on yleensä kiteinen rakenne. Metallin atomien välinen sidos suoritetaan valenssielektroneilla, jotka liikkuvat vapaasti sisään kidehilamuodostettu positiivisesti varautuneista metalli-ioneista. Jaksollisen taulukon 107 elementistä 83 on metalleja. Monet metallien toiminnallisista ominaisuuksista eivät riipu pelkästään niiden kemiallisista ominaisuuksista, vaan myös rakenteesta, jonka ne saavat valmistusmenetelmien ja myöhemmän prosessoinnin tuloksena. Tämä luo mahdollisuuden metallien ominaisuuksien laajaan muutokseen ja tekee niistä tärkeimpiä rakenteellisia, sähköisiä, mekaanisia ja muita materiaaleja. Nykyään metalleja käytetään laajalti eri tekniikan aloilla. Epämetallit - yksinkertaiset aineet, joilla ei ole taipuisuutta, metallinen kiilto, ovat huonoja lämmön- ja sähkönjohtajia. Ei-metallisille atomeille on pääasiassa ominaista kyky kiinnittää elektroneja, ts. muuttua negatiivisesti varautuneiksi ioneiksi. Ei-metalleihin sisältyy 22 alkuainetta: H, B, C, Si, N, P, As, O, S, Se, Te, halogeenit ja jalokaasut. Ei-metallioksidit ovat luonteeltaan happamia, ne vastaavat happea sisältäviä happoja. Amfoteeriset aineet - aineet, joilla on taipumus olla sekä happamia että emäksisiä. Amfoteerinen aineReagoimalla esimerkiksi vahvan emäksen kanssa sillä voi olla happamia ominaisuuksia, kun taas samalla aineella, reagoidessaan vahvan hapon kanssa, voi olla emäksisiä ominaisuuksia. Katso nro 2, s273, s279, s225.
harkita jaksollinen järjestelmä kemialliset alkuaineet. Se luodaan jaksollisen lain perusteella. Taulukko koostuu 7 jaksosta ja 8 ryhmästä.
Jaksot ovat taulukon vaakasuoria rivejä, ne jaetaan suuriin ja pieniin. Saippuajaksot sisältävät 2 elementtiä (1. jakso) tai 8 elementtiä (2. ja 3. jakso), suurina jaksoina 18 elementtiä (4. ja 5. jakso) tai 32 elementtiä (6. jakso) . Seitsemäs jakso ei ole vielä ohi. Mikä tahansa ajanjakso alkaa tyypillisellä metallilla ja päättyy tyypilliselle ei-metalli- ja jalokaasulle. Katso numero 1, s271.
Pystysarakkeita kutsutaan elementtiryhmiksi. Jokainen ryhmä on jaettu kahteen alaryhmään pää- ja sivuryhmiin. Alaryhmä on kokoelma elementtejä, jotka ovat kemiallisia analogeja. Usein alaryhmän elementeillä on korkea hapetustila, joka vastaa ryhmän numeroa. Katso numero 1, s271.
Pääryhmissä alkuaineiden kemialliset ominaisuudet voivat vaihdella suuresti.




