Elementin alumiinisijainti jaksollisessa järjestelmässä. Tutustua alumiinin teollisiin valmistusmenetelmiin ja ilmoittaa sen soveltamisala
Oppitunnin tavoitteet:
Koulutus -opiskele fyysistä ja kemialliset ominaisuudet alumiini ja sen laajuus. Näytä ominaisuus kemiallinen alkuaine alumiinia ja tutkia atomin rakennetta.
Kehitys - kehittää taitoja kokeen suorittamiseen siirtämällä tieteellis-kognitiivisen tekstin sisältöä kaavioiden muodossa; kommunikatiivisten kykyjen, kuuntelutaitojen, kyvyn ilmaista ajatuksiaan oikein.
Koulutus -edistää kemikaalien kanssa työskentelykulttuuria, turvallisuusmääräysten noudattamista, edistää tietoista kurinalaisuutta, selkeyttä ja työn organisointia.
Opiskelijoiden tulee tietää:
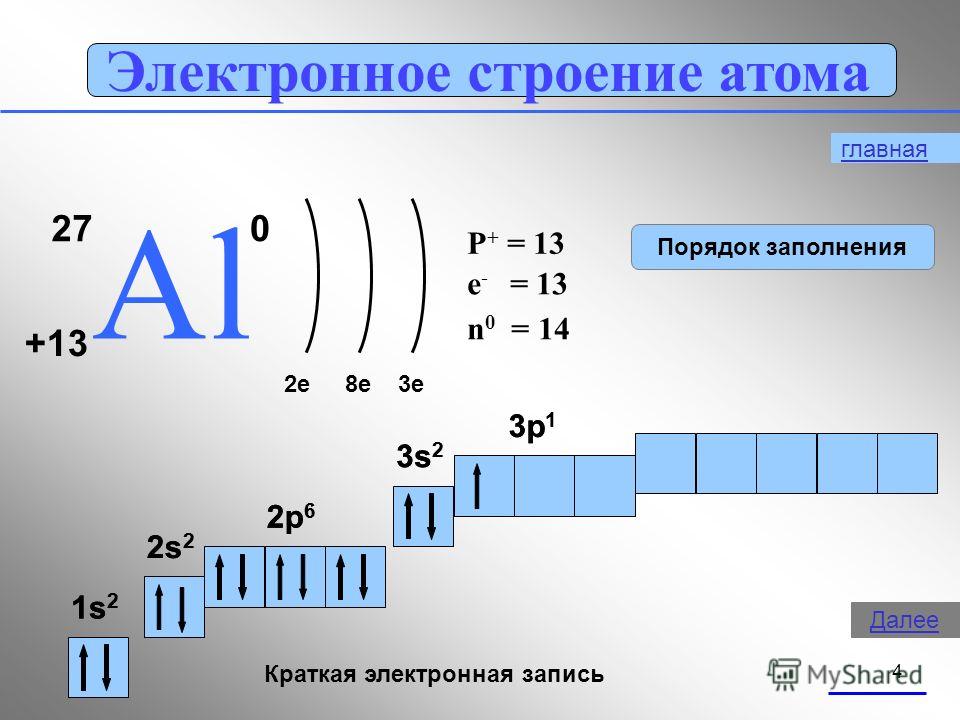
alumiiniatomin rakenne, alumiinin fysikaaliset ja kemialliset ominaisuudet yksinkertaisena aineena, soveltamisala.
Opiskelijoiden tulee kyetä:
karakterisoivat alumiinia, sekä kemiallista alkuainetta että yksinkertaista ainetta. Kirjoita reaktioyhtälöt, jotka osoittavat alumiinin kemialliset ominaisuudet molekyyli- ja redox-muodossa.
Oppitunnin tyyppi:
uuden materiaalin oppiminen.
Opiskelijoiden oppimisen organisoinnin muoto:
ryhmätyö, yksilöllinen, kemiallinen koe.
Harjoittelumenetelmät ja tekniikat:
haku, osittainen tutkimus, kemiallinen esittely, ryhmätyö, suulliset vastaukset taululle, itsenäinen työ teksteillä, keskinäinen valvonta.
Oppitunnin varustus:
tieteelliset ja opettavat tekstit oppitunnin aiheesta, tehtäväkortit yksittäisiin kysymyksiin suunnitelmasta kunkin ryhmän aineiston tutkimiseksi, PSE,
Kokoelma "Alumiini ja sen yhdisteet", alumiinifolio, suolahappo ja natriumhydroksidi, alumiini, laboratoriolaitteet.
Opettaja toivottaa opiskelijat tervetulleiksi.
2. Tukitietojen päivittäminen, aiheen viestintä, tehtävät ja oppitunnin rakenne:
Opettajan esittely
Sinä itse teet kaiken
ja rakkailleen ja itselleni,
ja jos työssä ei ole menestystä,
vika ei ole ongelma, yritä uudelleen.
D. Mendeleev.
Tutkimme edelleen metallien suurta ja tärkeää aihetta. Tänään oppitunnissa meidän on tutustuttava metalliin, jonka tunnet lapsuudesta lähtien. Haluan aloittaa tämän oppitunnin legendalla.
”Kerran muukalainen tuli Rooman keisarin Tiberiuksen luo. Lahjaksi keisarille hän toi kullan, jonka hän oli valmistanut kiiltävästä metallista, kuten hopeasta, mutta erittäin kevyestä metallista. Mestari kertoi minulle, että hän sai tämän metallin Clay Earthilta. Mutta keisari pelkäsi kullan ja hopean olevan arvoton, käski mestarin leikata ja hänen työpajansa tuhota. " Mistä metallista me puhumme?
(Tietoja alumiinista)
opettaja:
Siksi oppitunnimme teema on: "Alumiini on kemiallinen elementti ja yksinkertainen aine."
Oppitunnin tavoitteet on muotoiltu.
Suunnitelma aiheen tutkimiseksi ryhmissä:
- Alumiinin fysikaaliset ominaisuudet.
- Alumiinin kemialliset ominaisuudet.
- Alumiinin käyttö ja sen läsnäolo luonnossa.
Ryhmätyösuunnitelma:
Tutki teksti ja korosta kysymykseesi liittyvät tiedot;
- suorittaa ehdotetut tehtävät
- valmistele aiheesta esitys esityksen lyhyyden, selvyyden ja selkeyden perusteella
Ryhmätyö materiaalitutkimuksen kanssa.
Puheen valmistelu aiheesta.
Ryhmä 1.
Alumiinin kemiallisen elementin karakterisointi sen sijainnin perusteella PSChE: ssä.
asetus:
- Katso teksti.
- Anna alumiinin ominaisuudet PSHE: n tilanteen mukaan suunnitelman mukaan:
A) sarjanumero.
B) atomimassa.
C) ajanjakso (pieni, iso).
D) ryhmä (alaryhmä: pää- tai toissijainen).
D) kemiallinen merkki.
E) atomin rakenne (ydinvaraus, protonien lukumäärä, elektronit, neutronit, elektroninen kaava).
I) oksideja.
K) haihtuvat vetyyhdisteet.
2. Keskustele tuloksista ryhmässä ja vastaa kysymyksiin:
- Kuinka monta elektronia on alumiiniatomin ulkotasolla?
- Lähettääkö tai vastaanottaako alumiini nämä elektronit?
- Minkä hapettumisasteen alumiini-ioni saa tässä tapauksessa?
- Tee johtopäätös: Mihin yhdisteluokkaan alumiini (metalli tai ei-metalli) kuuluu?
- Vertaa alumiinin kemiallisen alkuaineen aktiivisuutta saman ajanjakson ryhmien 1 ja 2 alkioihin.
- Valmista esitys aiheesta esityksen lyhyestä, selkeästä ja selkeästä esityksestä.
Ryhmä 2
Alumiinin fysikaaliset ominaisuudet.
asetus:
- Katso teksti.
- Korosta kysymykseesi liittyvä materiaali.
- Selaa Aluminium and Alloys -kokoelmaa.
- Keskustele ryhmän kysymyksistä:
- a) Yhdistelmätila, väri, kiilto, tiheys (kevyt tai raskas), sulavuus (helppo tai tulenkestävä), sähkö- ja lämmönjohtavuus, muovi.
- b) Piirrä saadut tiedot kaaviona.
5. Valmistele esitys esitettyyn kysymykseen, perustuu selvyyden lyhyt kuvaus.
Ryhmä 3.
Alumiinin kemialliset ominaisuudet.
asetus:
- Katso teksti.
- Korosta kysymykseesi liittyvä materiaali.
- Opi kuinka alumiini käyttäytyy monimutkaisten aineiden suhteen?
- Suorita laboratoriotyöt ohjeiden avulla
asetus:
A) Suorita kokeet.
B) Keskustele havaittuista ilmiöistä ryhmässä.
C) Kirjoita reaktioyhtälö.
D) Tee johtopäätökset.
5. Valmistele esitys aiheesta perustuen esityksen lyhyyteen, selkeyteen ja selkeyteen.
Ryhmä 4.
Alumiinin käyttö.
asetus:
- Katso teksti.
- Korosta kysymykseesi liittyvä materiaali.
- Keskustele seuraavista kysymyksistä ryhmässä:
a) Mikä on alumiinin merkitys ihmisen elämässä?
b) Alumiinin käyttö yksinkertaisena aineena.
- Tee kaavio, joka kuvaa alumiinin laajuutta.
- Valmista esitys aiheesta, perustuu lyhyyteen, selkeyteen ja selkeyteen
- Tutkimusryhmien raportti.
Kukin ryhmä, joka on suorittanut kaikki tehtävät, esittelee kysymyksensä kaavamaisesti keskusteluineen ja kommentteineen, opiskelijat tekevät muistiinpanoja, siirtävät ehdotetut kaaviot muistikirjoihin ja kaikkien ryhmien tuloksena kootaan vaiheittain oppitunnin tukeva tiivistelmä.
Päätelmät oppitunnin aiheesta:
Kuinka monta elektronia on alumiiniatomin ulkoisella energiatasolla.
- Missä määrin hapettuminen alumiiniatomilla on? Miksi? Entä ioni?
"Millä kokeilla olemme osoittaneet, että alumiini on aktiivinen metalli?"
- Mitä aineita kutsutaan amfoteerisiksi?
- Mihin ominaisuuksiin seuraavat sovellukset perustuvat?
- Missä rungossa on eniten alumiinia?
- onko se mahdollista kauan säilytä ruokaa alumiinipakkauksissa?
- kotitehtäviä:§ 13 - s. 60,? 1, 4. Valmistele esitys alumiinin käytöstä.
- Opettajan lopullinen sana.
Opettaja kiittää opiskelijoita yhteistyöstä ja merkitsee puhujat taululle.
Ohje.
Alumiinia.
Ryhmän III pääryhmään kuuluvat elementit: boori, alumiini, gallium, indium, tallium. Ulommassa elektronisessa kerroksessa näiden elementtien atomit sisältävät kolme elektronia (... ns2np1). Ne ovat p-elementtejä. Reaktioissa näiden elementtien atomit ovat pelkistäviä aineita, paitsi ei-metalliboori, se voi olla hapettava aine. Kaikilla tämän alaryhmän elementeillä on korkea hapetustila (+3). Ne muodostavat korkeammat oksidit E2O3 ja hydroksidit E (OH) 3, joilla on amfoteerisiä ominaisuuksia. Suurinta kiinnostusta tässä alaryhmässä ovat alumiini.
Alumiini vapaassa muodossaan on hopeanvalkoinen metalli, sillä on kiiltävä, korkea lämmönjohtavuus (tässä suhteessa alempi kuin kupari), kevyt (tiheys 2,7 g / cm3) ja samalla se on kestävä metalli. Se on pehmeää, muovautuvaa metallia, se voidaan rullata folioon, vetää langaksi. Se sulaa 6600C: n lämpötilassa. 6000 ° C: ssa alumiini muuttuu hauraaksi ja voidaan murskata jyväksi tai jauheeksi.
Alumiini on metalli, jonka pinta on yleensä päällystetty ohuella, vahvalla oksidikalvolla. Lastujen ja jauheen muodossa se palaa kirkkaasti ilmassa, lähettäen paljon lämpöä.
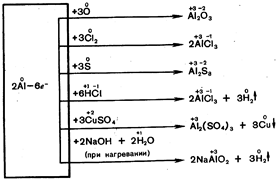
Huoneenlämpötilassa se reagoi aktiivisesti halogeenien kanssa, kuumennettuna se reagoi rikin (2000С), typen (8000 С) ja muiden ei-metallien kanssa.
Alumiinin ja monimutkaisten aineiden välinen suhde:
Alumiini liukenee suolahappoon minkä tahansa pitoisuuden:
Alumiini liukenee alkaliliuoksiin:
Alumiinilla on tärkeä rooli. biologinen rooli ihmisen elämässä. Hän osallistuu epiteeli- ja sidekudosten rakentamiseen. Alumiinipitoisuus ihmiskehossa (70 painokiloa kohti) on 61 mg. Sitä on kaikissa elimissä ja kudoksissa: ennen kaikkea maksassa, keuhkoissa ja aivojen luissa. Suurin alumiinin saanti kehossa on ruoka - se on leipomotuotteita, teetä (20 - 200 mg / 100 g tuotetta), perunoita - 4 mg / 100 g. tuote, keltainen nauri - 46 mg / 100 g tuotetta.
Kun ruokaa keitetään ja varastoidaan alumiiniastioissa, alumiinin pitoisuus tuotteissa kaksinkertaistuu. Veren alumiinisisällön lisääntyminen stimuloi keskushermostoa. Kun elimistössä on liikaa alumiinia, motorinen aktiivisuus, kouristukset, muistin heikkeneminen, maksa- ja munuaissairaudet ovat heikentyneet. Alumiinipitoisuuden vähentyessä tapahtuu keskushermoston inhiboituminen.
Alumiinin laajuudet ovat erittäin lukuisia. Kevyyden ja lujuuden vuoksi alumiinia ja sen seoksia käytetään lentokone- ja rakettotieteessä (alumiinia kutsutaan siivekäsmetalli), alusten ja autojen rakentamiseen; rakentamisessa - ikkunakehysten ja ovien valmistukseen alumiinin keveyttä ja hyvää sähkönjohtavuutta käytetään voimajohtojen sähköjohtojen valmistuksessa. Lämmönjohtavuus ja myrkyttömyys ovat tärkeitä valmistettaessa alumiinisia keittiövälineitä ja folioita elintarvikkeiden säilyttämistä varten. Alumiinijauhe on hopeamaidin valmistuksen perusta suojaamaan rautatuotteita korroosiolta. Alumiinin kykyä palaa ilmassa kirkkaassa liekissä käytetään värikkäiden ilotulitusten valmistukseen ja kipinöimien valmistukseen.
2.1.1 Alumiinin sijainti jaksollinen järjestelmä ja sen atomin rakenne
Alumiini kuuluu ryhmän III pääryhmään. Energiatasojen sijoittelu on seuraava:
3 Al 2e -, 8e -, 3e -
Koska alumiiniatomien ulkoisella tasolla on 3 elektronia, yhdisteiden alumiinin hapetustila on 4-3.
Olemme tulleet samaan johtopäätökseen, jota ohjaavat ideat atomien elektronien liikkeen luonteesta ja niiden sijoituksesta paitsi energiatasoilla, myös alatasoilla. Alumiiniatomissa tapahtuu helposti 3s2-elektronien pariliitos ja yksi elektroni kulkee 3p-kiertoradalle:
Tuloksena on kolme paritonta elektronia. Vastaa kysymykseen 1 (s. 138).
2.1.2 Alumiinin löytäminen luonteesta, sen tuotanto ja ominaisuudet
Alumiini on kolmanneksi runsas elementti maankuori. Sitä löytyy vain yhdisteistä. Tärkeimmät niistä on esitetty kaaviossa 19.
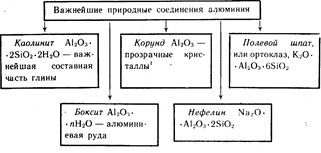
Punaisen Al 2 O 3: n värilliset kiteet ovat rubiineja, sininen väri on safiireja.
vastaanotto
Saksalainen kemisti F. Wöhler sai vuonna 1827 alumiinia kuumentamalla alumiinikloridia alkalimetallilla kaliumilla tai natriumilla ilman.
AlCl 3 + 3K 3KCl + Al
varten teollinen kuitti alumiinia, nämä menetelmät ovat taloudellisesti epäedullisia, siksi kehitettiin sähkökemiallinen menetelmä alumiinin valmistamiseksi bauksiitista.
Fysikaaliset ominaisuudet
Alumiini on hopeanvalkoinen metalli, kevyt (r \u003d 2,7 g / cm3), sulaa 660 ° C: ssa. Se on erittäin muovinen, vedetään helposti lankaan ja kalsinoidaan levyiksi ja folioksi. Sähkönjohtavuudessa alumiini on toisella sijalla vain hopealla ja kuparilla (se on 2/3 kuparin sähkönjohtavuudesta).
Kemialliset ominaisuudet
Sähkökemiallisissa jännitesarjoissa alumiini sijoitetaan aktiivisimpien metallien taakse. Jokapäiväisestä kokemuksesta tiedetään kuitenkin, ettei alumiini eikä vesi vaikutta alumiinituotteisiin (ruokailuvälineisiin jne.) Edes sen kiehumispisteessä. Väkevä kylmä typpihappo ei myöskään vaikuta alumiiniin. Tämä selitetään ohuen oksidikalvon läsnäololla alumiinin pinnalla, joka suojaa sitä lisähapettumiselta. Jos alumiinin pinta hierotaan elohopeaisuolalla, reaktio tapahtuu:
2A1 + 3HgCl2 ® 2A1C1 3 + 3Hg
Vapautunut elohopea liuottaa alumiinin ja muodostuu sen seos elohopean kanssa - alumiiniamalgaami. Kalvo ei pidä sulautuneella pinnalla, joten alumiini reagoi veden kanssa lämpötilassa normaalit olosuhteet (kuva 46):
2A1 + 6HOH ® 2A1 (OH) 3 + 3H2
Korotetussa lämpötilassa alumiini reagoi monien ei-metallien ja monimutkaisten aineiden kanssa ilman sulautumista:
hakemus
Alumiinia käytetään erilaisten seosten valmistukseen. Yleisimmät ovat kuparia ja magnesiumia sisältävät duralumiinit ja silumiinit - alumiiniseokset piin kanssa. Näiden seosten pääedut ovat keveys ja korkea lujuus. Mainittuja seoksia käytetään laajalti lentokone-, auto-, laiva- ja instrumenttivalmistuksessa, rakettitekniikassa ja rakentamisessa. Puhtaan metallin muodossa alumiinia käytetään sähköjohtojen ja erilaisten kemiallisten laitteiden valmistukseen.
Alumiinia käytetään myös teräs- ja valurautatuotteiden pintojen alitoimiseen eli kyllästämiseen alumiinilla suojaamaan niitä korroosiolta.
Käytännössä termiittiä käytetään usein (Fe 3O 4 -oksidin ja alumiinijauheen seos). Jos tämä seos sytytetään (käyttäen magnesiumteippiä), tapahtuu voimakas reaktio, kun vapautuu suuri määrä lämpöä:
8Al + 3Fe 3O 4 ® 4Al 2 O 3 + 9Fe
Tätä prosessia käytetään ns. Termiittihitsauksessa, samoin kuin joidenkin metallien saamiseksi vapaassa muodossa.
Vastaa kysymyksiin 2-6 (s. 138). Ratkaise ongelmat 1 - 2 (s. 138).
2.1.3 Välttämättömät alumiiniyhdisteet
alumiinioksidin
Al 2 O 3 voidaan saada seuraavilla tavoilla:
1. Metallialumiinijauheen suora palaminen (puhaltaa alumiinijauhetta polttimen liekkiin):
4Al + 3O 2 ® 2A1 2 O 3
2. Muuntamalla alla kuvatulla tavalla:
Alumiinioksidi on kiinteä, tulenkestävä (lämpötila pl. 2050 ° C), valkoisen värin aine.
Kemiallisten ominaisuuksien perusteella se on amfoteerinen oksidi (I, § 37). Reagoi happojen kanssa, osoittaa emäksisten oksidien ominaisuudet:
A1 2 O 3 + 6НС1 2А1С1 3 + 3Н 2 O
AI203 + 6H + + 6C1 - 2A1 3 + + 6C1 - + 3H20
A1203 + 6H + 2A1 3+ + 3H20
Alumiinioksidi reagoi emästen kanssa ja osoittaa happoksidien ominaisuuksia. Lisäksi fuusion aikana muodostuu metaalumiinihapon HA1O2 suoloja, ts. Metaaluminaatteja:
Al203 + 2NaOH 2NaA10 2 + H20
Veden läsnä ollessa reaktio etenee eri tavalla:
A1203 + 2NaOH + H202
Tämä johtuu siitä, että vesiliuoksessa natriumaluminaatti NaA1O2 kiinnittää yhden tai kaksi vesimolekyyliä, jotka voidaan esittää seuraavasti:
a) NaA1O2-H20 tai NaH2 A1O3; b) NaA1O2 -2H20 tai NaAl (OH) 4.
Alumiinihydroksidi
Alumiinihydroksidi A1 (OH) 3 saadaan emäsliuoksen vuorovaikutuksessa alumiinisuolojen liuosten kanssa (alkaliliuosta ei voida ottaa ylimäärin):
AlCl3 + NaOH ® Al (OH) 3 + + 3NaCl
A1 3+ + 3Cl - + 3Na + + 3OH - ® Al (OH) 3 ¯ + 3Na + + 3C1 -
Al 3+ + 3OH - ® A1 (OH) 3 '
Jos liuoksesta eristetään valkoinen alumiinihydroksidin geelimäinen massa ja kuivataan, saadaan valkoinen kiteinen aine, joka on käytännössä liukenematon veteen.
Alumiinihydroksidilla (kuten sen oksidilla) on amfoteeriset ominaisuudet. Kuten kaikki emäkset, alumiinihydroksidi reagoi happojen kanssa. Alumiinihydroksidin fuusion aikana alkalien kanssa muodostuu metaaluminaatteja, ja vesiliuokset - metaaluminaattien hydraatit:
A1 (OH) 3 + NaOH NaA1O2 + 2H20
A1 (OH) 3 + NaOH ® NaH2A1O3 + H20
Alumiinisuolat saadaan pääasiassa alumiinimetallin vuorovaikutuksessa happojen kanssa. päälle fysikaaliset ominaisuudet Nämä ovat kiinteitä kiteisiä aineita, jotka liukenevat hyvin veteen. Alumiinisuolojen kemialliset ominaisuudet ovat samanlaiset kuin muiden suolojen (, s. 98-99). Koska heikko emäs ja vahva happo muodostavat alumiinisuoloja, ne läpikäyvät hydrolyysin vesiliuoksissa (s. 18).
Vastaa kysymyksiin 7-10 (s. 138). Ratkaise ongelma 3 (s. 138).
Geneettinen yhteys alumiinin ja sen tärkeimpien yhdisteiden välillä (kaavio 20).
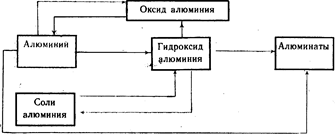
Edellä esitetystä aineistosta voimme siis päätellä, että koulujen opetussuunnitelmissa on hyvin vähän tunteja varattu tämän aiheen tutkimiseen, ja lisäksi aiheen ympäristönäkökohdista ei käytännössä ole tietoa.
Typpi muodostaa sarjan oksideja, jotka vastaavat muodollisesti kaikkia mahdollisia hapetustiloja välillä +1 - +5: N 2 O, NO, N 2 O 3, NO 2, N 2 O 5, mutta vain kaksi niistä on typpioksidi (II) ja oksidi Typpi (IV) - ei vain vakaa normaaleissa olosuhteissa, vaan osallistuu aktiivisesti myös luonnollisiin ja teollisiin typpisykleihin.
2.2.1 Jotkut typpiyhdisteet ja niiden ominaisuudet 1.2.1.1. Typpioksidit
N 2 + 1 O - typpioksidi (I), typpioksidi, "naurava" kaasu, ei suolaa muodostava oksidi. Saa ammoniumnitraatin hajoamista N 2 O:
N 2 O: lla on heikko miellyttävä tuoksu ja makea maku. Se ei reagoi hapen, veden, happojen ja emästen liuosten kanssa. Se hajoaa alkuaineiksi yli 500 ° C lämpötilassa, toisin sanoen, se on melko vakaa.
Rakenne: Hapessa on 2 paritonta elektronia, typessä 3 on kaksoissidos ja yhdellä parittomat elektronit jäännöksessä. Voidaan olettaa, että NO-molekyylit muodostavat parin ja muodostavat ONNO-dimeerisen molekyylin. Molekyylin rakenne: lineaarinen molekyyli O \u003d N \u003d N, jossa keskiatomi N on tetravalentti. Se muodostaa kaksi kaksoissidosta: yhden hapen kanssa tyypillisen kaavan mukaan kovalenttisen sidoksen luomiseksi (kaksi typpielektronia, kaksi hapen elektronia), toisen typpiatomin kanssa (joka parittaa kaksi kolmesta parittomasta elektronista ja muodostaa tyhjän kiertoradan), toisen kovalenttisista sidoksista, toinen on luovuttaja-vastaanottaja (kuva 1).
Typpioksidin (I) tuotantoon tarkoitettu laite koostuu jalustaista, koeputkista, korkista, joissa on kaasunpoistoputki, kiteyttimestä, sylinteristä ja alkoholilampusta (kuva 2). NH4N03 asetetaan putkeen, suljetaan kaasuputken tulpan kanssa ja lämmitetään. Kaasu kerätään vesisäiliöön.
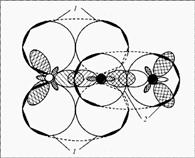
Kuva 1. Typpioksidin (I) - N2O molekyyli
N 2 Ooksidi hajoaa kuumentuessa:
N2O-oksidi reagoi vedyn kanssa:
N + 2 O - typpioksidi (II), ei suolaa muodostava oksidi. Saa NO: ta kuparin reaktiolla hapon HN03: n kanssa (hajoaa) (kuva 3).
Kristallihila molekyyli-; molekyyli on kevyt, hieman polaarinen (hapen elektronegatiivisuus on hiukan korkeampi kuin typen). Voidaan olettaa, että sulamis- ja kiehumispisteet ovat alhaiset, mutta korkeammat kuin typen, koska molekyylin napaisuus mahdollistaa sähköstaattisten houkuttelevien voimien yhdistämisen yksinkertaisesti molekyylien välisiin voimiin. Dimeerin muodostuminen lisää myös kiehumispistettä. Molekyylin rakenne viittaa matalaan liukoisuuteen veteen. Typpioksidi (II) ei ole väri eikä haju.
Typpioksidin (II) saamiseksi asetetaan pieni määrä kuparilastuja koeputkeen ja lisätään laimennettua typpihappoa. Putki suljetaan kaasuputken tulpalla ja kiinnitetään jalustaan. Tuuletusputken pää lasketaan muottiin vedellä ja sitten sylinteriin (kuva 3). Kuumennettaessa NO vapautuu. NO hapettuu helposti ilmakehän hapella, ts. Toimii pelkistimenä:
![]()
Reaktiossa rikkidioksidin kanssa NO-oksidi on hapettava aine:
![]()
N +2 2 O 3 - typpioksidi (III), typpianhydridi (typpihappo HNO 2 ja nitriittisuolat vastaavat sitä); se on happooksidi; kaikki happooksidien ominaisuudet ovat sille ominaisia. Saada oksidi N 2 O 3 reaktiolla:
NO 2 + NO N 2 O 3.
N +4 O 2 - typpioksidi (IV), typpidioksidi, ruskea kaasu (myrkyllinen).
Tarkastellaan typpielektroneja NO-molekyylissä. Tämä on pariton elektroni, vapaa elektronipari ja kaksi muuta elektronia, jotka ovat yhteydessä happeen - vain viisi. Ja "kosketuksissa olevassa" happiatomissa on kuusi elektronia neljällä kiertoradalla. Jos järjestelet ne kahteen, yksi kiertorata pysyy vapaana. Juuri tämän typpiatomin elektronipari vie (kuva 4, 5).
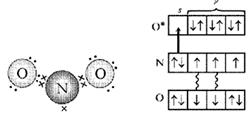
Kuva 4. Molekyylin NO2 elektroninen rakenne (ensimmäinen vaihtoehto). (Pisteet merkitsevät O-atomien elektroneja, ristit osoittavat N-atomin elektroneja)
Kuva 5. Molekyylin NO2 elektroninen rakenne (toinen vaihtoehto). (Tähti tarkoittaa herätettyä O-atomia ja nuoli osoittaa luovuttaja-vastaanottaja-sidosta.
Koska pari elektronia, joka sijaitsee s-kiertoradalla ”tehty kosketin”, sen on yksinkertaisesti läpikäynyt hybridisaatio. Herää kysymys: millaista hybridisaatiota atom käyttää? Vastaus: kolme elektronista typpiorbitaalia on sp 2 -hybridisaation tilassa. NO2-molekyyli on kulma, kulma on 134 ° (kulma on suurempi kuin 120 °, koska 1 elektroni hylkii sitoutumiselektroneja heikommin kuin elektronien pari) (kuvat 6, 7).
Kidehila on molekyyli, mutta koska itse molekyyli on raskaampaa kuin NO ja sen taipumus dimeroitua on huomattavasti suurempi, tämän aineen tulisi sulaa ja kiehua huomattavasti korkeammissa lämpötiloissa. Kiehumispiste on 21 ° C, joten normaaleissa olosuhteissa - 20 ° C ja 760 mm RT. Art. - typpioksidi (IV) neste.
Typpioksidi (IV) vedessä liukenee reagoidessaan samanaikaisesti sen kanssa, ja saadaan kaksi happoa samanaikaisesti.
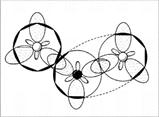
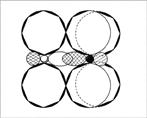
Kuva 6. NO 2-molekyyli - ylhäältä päin
Kuva 7. Molekyyli NO 2 - sivukuva luovuttaja-vastaanottaja-sidoksen sivulta. (Toinen happiatomi ei ole näkyvissä typpiatomin orbitaalien ulkopuolella. Varjostetut ympyrät ovat hybridisoituneita atomiorbitaaleja, jotka on suunnattu lukijaa kohti.)
Typpioksidilla (IV) on ominainen pistävä haju ja punertavanruskea väri, jonka sävyt eroavat toisistaan \u200b\u200bpitoisuudesta riippuen. Juuri tämän värin typpioksidipäästöjä ilmakehään kutsutaan "ketun hänniksi".
NO 2 -oksidireaktiot
1) vedellä:
2NO 2 + H 2 O \u003d HNO 3 + HNO 2.
2) Emäksillä:
2NO2 + 2NaOH \u003d NaN03 + NaNO2 + H20.
3) dimerointi jäähdytyksen aikana:
![]()
Lämpötilassa –11 ° С tasapaino siirtyy täysin oikealle ja +140 ° С lämpötilassa - täysin vasemmalle.
N +5 2 O 5 - typpioksidi (V), typpihappoanhydridi, happooksidi, voimakas hapettava aine. Oksidi N 2 O 5 hajoaa helposti:
2N 2 O 5 \u003d 4 N02 + O 2.
2.2.1.2 typpihappo
Typen hydroksidista pidämme eniten tonnimäärää - typpihappoa.
Typpihappomolekyyli on polaarinen (johtuen hapen ja vedyn erilaisesta elektronegatiivisuudesta, koska typpi on piilossa molekyylin sisällä) ja on epäsymmetrinen. Kaikki siinä olevat typen ja hapen sidosten väliset kulmat ovat erilaisia. Muodollinen typen hapetustila on korkein (+5). Mutta samalla typpiatomissa on vain 4 sidosta muiden atomien kanssa - typen valenssi on 4.
Molekyylin rakenne on helpompi ymmärtää, jos tarkastellaan sen valmistusprosessia. Typpihappoa saadaan typpioksidin (IV) reaktiolla veden kanssa (hapen läsnä ollessa): kaksi NO2-molekyyliä “hyökkää” samanaikaisesti vesimolekyyliin parittomilla elektroneillaan, mistä seuraa, että vedyn sidos happea hajoaa normaalisti (pari elektronia happea ja “paljaa”). protoni ”), ja yksi NO2-molekyyli saa vetyä elektroninsa kanssa, toinen - OH-radikaalin kanssa (kuva 8). Muodostuu kaksi happoa: molemmat hapot ovat vahvoja, molemmat vapauttavat protoninsa nopeasti lähimpiin vesimolekyyleihin ja pysyvät lopulta NO 2 - ja NO 3-ionien muodossa. NO2-ioni on epästabiili, kaksi HNO2-molekyyliä hajoaa veteen, NO 2 ja NO. EI oksidi reagoi hapen kanssa, muuttuu typpioksidiksi, ja niin edelleen, kunnes saadaan vain typpihappoa.
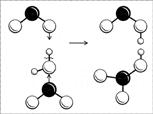
Kuva 8. Kaavio typpi- ja typpihappojen molekyylien muodostumiseen. (Musta pallo on atomi N, suuret valkoiset pallot ovat O-atomeja, pienet valkoiset pallot ovat H.-atomeja)
Muodollisesti käy ilmi, että yhdellä happiatomilla typpiatomi on kytketty kaksoissidoksella ja toisella tavallisella yksinkertaisella sidoksella (tämä happiatomi on kytketty myös vetyatomiin). HN03: n typpi on sitoutunut kolmanteen happiatomiin luovuttaja-vastaanottaja-sidoksella, ja typpiatomi toimii luovuttajana. Typpiatomin hybridisaation tulisi tässä tapauksessa olla sp 2 johtuen kaksoissidoksesta, joka määrää rakenteen - tasaisen kolmion. Oikeastaan \u200b\u200bkäy ilmi, että typpiatomin ja kolmen happiatomin fragmentti on todellakin tasainen kolmio, vain typpihappomolekyylissä tämä kolmio on väärä - kaikki kolme ONO-kulmaa ovat erilaisia, siis kolmion eri puolilla. Kun molekyyli dissosioituu, kolmio muuttuu säännölliseksi, tasasivuiseksi. Siksi sen happiatomeista tulee vastaavia. Kaikista yhteyksistä tulee samat.
Typpihapon fysikaaliset ominaisuudet
Ionisoitu yhdiste on vaikea muuntaa kaasuksi, vaikka se olisikin osittain. Siksi kiehumispisteen tulisi olla riittävän korkea, mutta niin pienellä molekyylipainolla sulamispisteen ei tulisi olla korkea. Siksi aggregaation tila 20 ° C: ssa on nestemäistä. Liukoisuuden suhteen, kuten monien muiden polaaristen nesteiden kanssa, typpihappo sekoittuu helposti veden kanssa missä tahansa suhteessa. Puhdas typpihappo on väritön ja hajuton. Koska se hajoaa happeaksi ja typpioksidiksi (IV), joka liukenee siihen, voidaan kuitenkin sanoa, että tavallisella väkevällä typpihapolla on väriltään kellanruskea ja typpeä haju, joka on ominainen typpioksidille. Katsotaan kuinka typpihappomolekyylin rakenne vaikuttaa sen kemiallisiin ominaisuuksiin.
HNO 3 - vahva hapettava aine
HN03: n vuorovaikutuksessa metallien (M) kanssa vety ei vapaudu:
M + HNO 3 ® suola + vesi + kaasu.
Seosta, joka koostuu HN03: sta (kons.) HCl: n kanssa (kons.), Tilavuussuhteessa 1: 3 (1 V HN03 + 3 V HCI), kutsutaan "aqua regia".
Au + HNO 3 + 3HCl \u003d AuCl 3 + NO + 2H 2 O.
Typpihappo ei reagoi muiden happojen kanssa metabolisina tai yhdistereaktioina. Se kykenee kuitenkin reagoimaan vahvana hapettimena. Väkevöityjen typpihapon ja kloorivetyhappojen seoksessa etenevät palautuvat reaktiot, joiden ydin voidaan yleistää yhtälöllä:
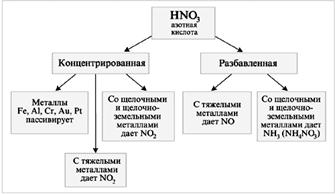
Tulokseksi saatu atomikloori on erittäin aktiivinen ja poimii helposti elektroneja metalliatomeista, ja kloridi-ioni muodostaa stabiilit kompleksi-ionit tuloksena olevien metalli-ionien kanssa. Tämän kaiken avulla voit kääntää jopa kullan ratkaisuksi. Väkevä H 2SO 4 voimakkaana vedenpoistoaineena edistää typpihapon hajoamista typpioksidiksi (IV) ja hapeksi. Typpihappo on yksi vahvimmista epäorgaanisista hapoista ja reagoi luonnollisesti alkalien kanssa. Hän reagoi myös liukenemattomat hydroksidit, ja emäksisillä oksideilla.
Kun tutkitaan aihetta “Typpi. Typpiyhdisteitä ”käytetään kemian oppikirjassa, jonka on toimittanut G.E. Rudzitis, F.G. Feldman, myös luokan 9 oppikirja, toimittanut N.S. Akhmetov. Didaktinen aineisto on kemian kirja luokille 8–9, toimittaneet A. M. Radetsky, V. P. Gorshkov; käytetty tehtäviä itsenäiselle kemian työlle luokalle 9, toimittanut R.P. Surovtseva, S.V. Sofronova; käytti kokoelmaa kemian ongelmista lukiossa ja yliopistoihin päästäville G.P. Khomchenko, I.G. Khomchenko. Aiheen tutkiminen kestää 7 tuntia.
LUKU 3. SATAKKEISET SUHTEET MÄÄRÄAIKAISEN JÄRJESTELMÄN III- JA V-RYHMÄN TUTKIMUKSESSA III-A-ryhmä 3.1.1 Boori 3.1.1.1 Luonnon jakautuminen
Booria ei löydy luonnosta koskaan vapaassa tilassa, se on aina sitoutunut happea. Tässä muodossa sitä on boorihapossa H 3 BO 3, jota esiintyy tulivuoren alueiden kuumien lähteiden vedessä. Lisäksi lukuisat boorihapon suolat ovat yleisiä luonteeltaan. Näistä suoloista booraks tai tinaali Na2B4O7 tunnetaan parhaiten. 10H 2 O. Boracite 2Mg 3 B 8 O 15 ovat teknisesti tärkeitä. MgCl2, Pandermiitti Ca2B6O11. 3H 2 O, kolemaniitti Ca 2 B 6 O 11. 5H20, cerniitti Na2B4O7. 4H20.
Seuraavat mineraalit, jotka ovat boorihapon johdannaisia, on ilmoitettava: borokalsiitti CaB 4 O 7. 4Н 2 О, boori-natrokalsiitti NaСаB 5 О 9. 6H20, hydroborasiitti MgCaB6O11. 6H20, boorimagneesiitti 2Mg 5B4O11. 5H20, syngaliitti MgAlBO 4 jne.
3.1.1.2 Biokemiallinen rooli
Boorilla ja sen yhdisteillä on suuri merkitys kansantaloudessa. Isotooppia 5 10 B, joka absorboi neutroneja, käytetään ydintekniikassa hidastamaan ydinketjureaktioita. Boraxia ja boorihappoa on käytetty pitkään lääketieteessä antiseptisinä aineina.
Boorin fysiologinen ja biologinen aktiivisuus on erittäin korkea. Boori pystyy vaikuttamaan eläinten ja kasvien tärkeimpiin biokemian prosesseihin. Yhdessä Mn: n, Cu: n, Zn: n ja Mo: n kanssa boori on yksi viidestä elintärkeästä hivenaineesta. Boori on keskittynyt luihin ja hampaisiin, lihaksiin, luuytimeen, maksaan ja kilpirauhanen. On todennäköistä, että se nopeuttaa organismien kasvua ja kehitystä. Tämä käy ilmi boorin vaikutuksesta kasveihin. Boorihapattamisen myötä sato ja erityisesti siementen lukumäärä vähenevät merkittävästi. Eläinten elämän kannalta on tärkeää, että se löytyy maidosta (lehmä) ja kananmunien keltuaisesta. Jotkut kasvit (rehuyrtit ja sokerijuurikkaat) keräävät useita grammia booria hehtaarilta. Booria on huomattavia määriä joidenkin boorilla rikastettujen laitumien laiduntavien eläinten rasvakudoksissa. Booriyhdisteiden koostumus kehossa ei ole tiedossa. Todettiin, että boori estää suolen amylaasia ja suoliston proteinaaseja, tehostaa insuliinin vaikutusta ja estää adrenaliinin hapettumista, heikentää vitamiineja B 2 ja B 12. Kun booria on enemmän, boorilainen enteriitti ilmenee. Liiallinen booripitoisuus johtaa kasvitautiin. Vehnä ja kaura kärsivät maaperän ollessa 0,7 - 0,8 mgV / kg. Boorin suolapitoisuutta säädellään boorimailla huuhtelemalla.
Ja koulutuksen järjestämisen didaktiset perusteet antavat helpomman selittää fysiikan oppitunneissa tutkittavan materiaalin tutkiessaan aihetta "Sähköodynamiikan perusteet". Eri tekniikoiden analysointi mahdollisti tekijän tekniikan laatimisen opiskelijoiden keskittymisen kehittämiseksi vuorovaikutteiseen viestintään ryhmäkoulutuksen muodossa. Siitä, kuinka paljon oppimisprosessi rakennetaan käytettäessä ...
Tämän kanssa on tarpeen harkita suhdetta molekyylifysiikka ja kemia lukion kurssilla. Molekyylifysiikan tutkimuksessa sen suhde kemiaan ilmenee kahdessa pääsuunnassa. Ensimmäinen niistä on kemian opiskeluprosessissa saatujen opiskelijoiden tietojen käyttäminen materiaalina todistamaan molekyylifysiikan perusperiaatteet. Toinen ...
Päivämäärä _____________ Luokka _______________
Aihe: Alumiini. Alumiinin sijainti jaksollisessa järjestelmässä ja sen atomin rakenne. Oleminen luonnossa. Alumiinin fysikaaliset ja kemialliset ominaisuudet.Oppitunnin tavoitteet:
ota huomioon alumiinin jakautuminen luonnossa, sen fysikaaliset ja kemialliset ominaisuudet sekä sen muodostamien yhdisteiden ominaisuudet.
Työn eteneminen
1. Oppitunnin organisatorinen hetki. 2. Uuden materiaalin tutkimus. alumiiniPääryhmäIII jaksollisen järjestelmän ryhmät ovat boori (B), alumiini (Al) gallium (Ga), indium (In) ja tallium (Tl). Kuten yllä olevista tiedoista voidaan nähdä, kaikki nämä elementit avattiin vuonna 2006XIX luvulla. Pääryhmän metallien löytö III ryhmät| 1806 g | 1825 | 1875 | 1863 | 1861 |
| G. Lussac, | G. H. Oersted | L. de Bouabodran | F. Reich, | W. Crookes |
| L. Tenard | (Tanska) | (Ranska) | I. Richter | (Englanti) |
| (Ranska) | (Saksa) |
| Innoissaan tila 1 s 2 2 s 2 2 p 6 3 s 1 3 p 2 |
| Al 2 O 3 | korundi |
| rubiini |
|
| safiiri |
minä . Yhteisvaikutukset yksinkertaisten aineiden kanssa Jo huoneenlämpötilassa alumiini reagoi aktiivisesti kaikkien halogeenien kanssa muodostaen halideja. Kuumennettuna se on vuorovaikutuksessa rikin (200 ° C), typen (800 ° C), fosforin (500 ° C) ja hiilen (2000 ° C) kanssa jodin kanssa katalyytin - veden läsnä ollessa:2A l + 3 S \u003d A l 2 S 3 (alumiinisulfidi),2Al + N2 \u003d 2AlN (alumiininitridi),A l + P \u003d A l P (alumiinifosfidi),4A1 + 3C \u003d A 1 4 C3 (alumiinikarbidia).2 Al + 3 I 2 \u003d 2 A II 3 (alumiinijodidi)Kaikki nämä yhdisteet hydrolysoidaan kokonaan alumiinihydroksidin ja vastaavasti rikkivedyn, ammoniakin, fosfiinin ja metaanin muodostamiseksi: Al 2 S 3 + 6H 2 O \u003d 2Al (OH) 3 + 3H 2 SAl 4 C 3 + 12H 2 O \u003d 4Al (OH) 3 + 3CH 4 Lastujen tai jauheen muodossa se palaa kirkkaasti ilmassa ja vapauttaa suuren määrän lämpöä:4A1 + 3 O 2 \u003d 2A I 2 O 3 + 1676 kJ.
II. Yhteisvaikutukset monimutkaisten aineiden kanssa Veden vuorovaikutus : 2 Al + 6 H20 \u003d 2 Al (OH) 3 + 3 H2 ei oksidikalvoa Yhteisvaikutukset metallioksidien kanssa: Alumiini on hyvä pelkistin, koska se on yksi aktiivisista metalleista. Se on sarjassa toimintoja heti alkalimetallimetallien jälkeen. siksipalauttaa metallit niiden oksidista . Tällaista reaktiota - aluminotermiaa - käytetään puhtaiden harvinaisten metallien, kuten esimerkiksi volframin, vanadiinin, jne. Saamiseksi.3 Fe 3 O 4 + 8 Al \u003d 4 Al 2 O 3 + 9 Fe + Q Termite seos Fe 3 O 4 ja Al (jauhe) - käytetään myös termiittihitsauksessa. С r 2 О 3 + 2А l \u003d 2С r + А l 2 О 3 Happovuorovaikutus : Rikkihappoliuoksella: 2 Al + 3 H 2SO 4 \u003d Al 2 (SO 4) 3 + 3 H2 Kylmällä väkevällä rikkihapolla ja typpi ei reagoi (passivoi). Siksi typpihappo kuljetetaan alumiinisäiliöissä. Kuumennettaessa alumiini pystyy palauttamaan nämä hapot ilman vedyn muodostumista:2А l + 6Н 2 SO 4 (conc) \u003d А l 2 (SO 4) 3 + 3 SO 2 + 6Н 2 О, А + 6Н NO 3 (conc) \u003d А l (NO 3) 3 + 3 NO 2 + 3H20. Alkali-vuorovaikutus . 2Al + 2 NaOH + 6H 2O \u003d 2 Na2Al (OH) 4 + 3H2 na[A l(OH) 4 ] – natriumtetrahydroksoaluminaatti Kemisti Gorbovin ehdotuksesta Venäjän ja Japanin sodassa tätä reaktiota käytettiin vedyn tuottamiseen ilmapalloihin. Suolaliuoksilla: 2Al + 3 CuSO 4 \u003d Al 2 (SO 4) 3 + 3 Cu Jos alumiinin pinta hierotaan elohopeaisuolalla, reaktio tapahtuu: 2 Al + 3 HgO 2 = 2 AICI 3 + 3 hgVapautunut elohopea liuottaa alumiinin muodostaen amalgaamin. 5. Alumiinin ja sen yhdisteiden käyttö
Alumiinin fysikaaliset ja kemialliset ominaisuudet ovat johtaneet sen laajaan käyttöön tekniikassa.Suurin alumiinin kuluttaja on ilmailuala. : 2/3 lentokoneesta koostuu alumiinista ja sen seoksista. Teräskone olisi liian raskas ja voisi kuljettaa paljon vähemmän matkustajia.Siksi alumiinia kutsutaan siivekäsmetalli. Kaapelit ja johdot on valmistettu alumiinista : jolla on sama sähkönjohtavuus, niiden massa on 2 kertaa pienempi kuin vastaavat kuparituotteet.Koska alumiinin korroosionkestävyys, siitätee typpihappolaitteiden ja säiliöiden osia . Alumiinijauhe on hopeamaalin valmistuksen perusta suojaamaan rautatuotteita korroosiolta ja heijastamaan lämpöä, maalia käytetään öljyvarastoissa ja palontorjuntapukuissa.Alumiinioksidilla valmistetaan alumiinia sekä tulenkestäviä materiaaleja.Alumiinihydroksidi on maaloxin, almagelin, tunnettujen lääkkeiden pääkomponentti, joka vähentää mahalaukun mehujen happamuutta. Alumiinisuolat hydrolysoituvat. Tätä ominaisuutta käytetään vedenpuhdistusprosessissa. Alumiinisulfaattia ja pieni määrä hiottua kalkkia johdetaan puhdistettuun veteen muodostuneen hapon neutraloimiseksi. Seurauksena on, että alumiinihydroksidista vapautuu irtotavaraosa, joka laskeutuessaan kantaa mukana suspendoituneita sameuden hiukkasia ja bakteereja.Siten alumiinisulfaatti on koagulantti.6. Alumiinin tuotanto 1) American Hall ja ranskalainen Eru keksivät nykyaikaisen, kustannustehokkaan alumiinin valmistusmenetelmän vuonna 1886. Se koostuu alumiinioksidiliuoksen elektrolyysistä sulassa kryoliitissa. Sulan kryoliitti Na 3 AlF6 liuottaa AI203: n, kuinka vesi liuottaa sokerin. Alumiinioksidin ”liuoksen” elektrolyysi sulassa kryoliitissa tapahtuu ikään kuin kryoliitti olisi vain liuotin ja alumiinioksidi olisi elektrolyytti.2Al 2 O 3 sähkövirta → 4Al + 3O 2 Englantilaisessa poikien ja tyttöjen tietosanakirjassa alumiinia käsittelevä artikkeli alkaa seuraavilla sanoilla: ”23. helmikuuta 1886 sivilisaation historiassa alkoi uusi metallikausi - alumiinin aika. Sinä päivänä 22-vuotias kemisti Charles Hall tuli ensimmäisen opettajansa laboratorioon kymmenellä pienellä hopeanvalkoisesta alumiinista valmistetulla pallolla kädessään ja uutisten kanssa, että hän oli löytänyt tavan valmistaa tämä metalli edullisesti ja suurina määrinä. " Joten Hallista tuli amerikkalaisen alumiiniteollisuuden perustaja ja anglosaksi kansallinen sankariihmisenä, joka on tehnyt hienoa yritystä tieteestä. 2) 2Al 2 O 3 + 3 C \u003d 4 AI + 3 CO 2 TÄMÄ on mielenkiintoista:
- Tanskalainen fyysikko Hans Christian Oersted tunnisti alumiinimetallin ensimmäisenä vuonna 1825. Ohjaamalla kaasumainen kloori hiilen kanssa sekoitetun kuuman alumiinioksidikerroksen läpi, eristettiin eristetty alumiinikloridi ilman mitään kosteutta. Metallisen alumiinin palauttamiseksi Oersted joutui käsittelemään alumiinikloridia kaliumamalgaamilla. Kahden vuoden kuluttua saksalainen kemisti Friedrich Wöller. Hän paransi menetelmää korvaamalla kaliumamalgaamin puhtaalla kaliumilla.
18–19-vuosisatojen aikana alumiini oli tärkein korumetalli. Vuonna 1889 Lontoon D.I. Mendeleev sai arvokkaan lahjan ansioistaan \u200b\u200bkemian kehittämisessä - kullasta ja alumiinista valmistetut vaa'at.
Vuoteen 1855 mennessä ranskalainen tutkija Saint-Clair Deville kehitti menetelmän alumiinimetallin tuottamiseksi teknisessä mittakaavassa. Mutta menetelmä oli erittäin kallis. Deville nautti Ranskan keisari Napoleon III: n erityisestä suojelusta. Merkkinä omistautumisestaan \u200b\u200bja kiitollisuudestaan \u200b\u200bPaholainen teki vastasyntyneen prinssin Napoleonin pojalle tyylikkäästi kaiverretun helistin - ensimmäiset "kulutustavarat", jotka on valmistettu alumiinista. Napoleon aikoi jopa varustaa vartijansa alumiinirunkoilla, mutta hinta oli kohtuullinen. Tuolloin 1 kg alumiinia oli arvoltaan 1000 markkaa, ts. 5 kertaa kalliimpaa kuin hopea. Vasta elektrolyyttisen prosessin keksimisen jälkeen alumiinista tuli arvonsa yhtä suuri kuin tavalliset metallit.
Mutta tiesitkö, että alumiini, joutuessaan ihmiskehoon, aiheuttaa hermoston häiriöitä. Ylimääräisenä aineenvaihdunta häiriintyy. Suoja-aine on C-vitamiini, kalsiumyhdiste, sinkki.
Kun alumiini palaa happea ja fluoria, vapautuu paljon lämpöä. Siksi sitä käytetään lisäaineena rakettipolttoaineeseen. Saturnuksen raketti polttaa lennon aikana 36 tonnia alumiinijauhetta. Ajatuksen metallien käytöstä rakettipolttoaineen osana ilmaisi ensin F. A. Zander.
Think! Miksi tätä reaktiota ei voida suorittaa vesiliuoksessa? №2. Täytä kemiallinen yhtälö:
Al + H2S04 (liuos) -\u003e
Al + CuCl2 -\u003e
Al + HN03 (kons) - t -\u003e
Al + NaOH + H20 -\u003e Ei. 3. Ratkaise ongelma:
Alumiinin ja kuparin seokselle vaikutti ylimäärä väkevää natriumhydroksidiliuosta kuumennettaessa. 2,24 litraa kaasua erottui (n.o.). Laske seoksen prosentuaalinen koostumus, jos sen kokonaismassa oli 10 g?4. Kotitehtävät A.42, ohjaus. 1-11. Tehtävät 1-3 sivulla 131
3 pääkarakterisoi elementti lisäämällä puuttuvat sanat 1. Alumiini - ryhmän III elementti, pääryhmä. 2. Alumiiniatomin ytimen varaus on yhtä suuri kuin 13 protonia alumiiniatomin ytimessä. 4. Alumiiniatomin ytimessä on 14 neutronia. 5. Alumiiniatomissa on 13 elektronia. 6. Alumiiniatomilla on 3 energiatasoa. 7. Elektronisen kuoren rakenne on 2e, 8e, 3e. 8. Ulkoisella tasolla atomissa on 3 elektronia. 9. Yhdisteiden atomien hapettumisaste on sama: yksinkertainen aine alumiini on metalli. 11. Alumiinioksidi ja hydroksidi ovat luonteeltaan amfoteerisia. edelleen
4 Atomin elektroninen rakenne 27 AlAl e8e3e P + \u003d 13 n 0 \u003d 14 e - \u003d 13 1s21s2 2s22s2 2p 6 3s 2 3p 1 Lyhyt sähköinen tietue 1s21s2 2s22s2 2p 6 3s 2 3p 1 Täyttötilauksen pääasiallinen Seuraava

7 Löytöhistoriasta Britit halusivat kunnioittaa suuren venäläisen kemian D.I. Mendelejevin rikkaan lahjan, antoi hänelle kemiallinen tasapainojossa yksi kuppi oli tehty kullasta, toinen alumiinista. Kuppi alumiinia on tullut kalliimpaa kuin kulta. Tuloksena saatu "hopea savista" kiinnosti tutkijoita, mutta myös teollisuusyrityksiä ja jopa Ranskan keisaria. edelleen


12 1. hopeanvalkoinen metalli 2. metalli kiilto 3. kovin metalli 4. sulamispiste +660 о С 5. muovi 6. helppo leikata veitsellä 7. johtimet sähkövirta 8. Valo 9. Johtaa lämpöä 10. Helppo magnetoida ja magnetoida 11. Pehmeä Valitse ja kirjoita niiden ominaisuuksien numerot, jotka liittyvät alumiinin fysikaalisiin ominaisuuksiin




VARALLINEN TALOUSARVION KOULUTUSLAITOS
YLEINEN KOULU № 81
Alumiinia. Alumiinin sijainti jaksollisessa järjestelmässä ja sen atomin rakenne. Oleminen luonnossa. Alumiinin fysikaaliset ja kemialliset ominaisuudet.
kemian opettaja
MBOU OSH №81
2013
Oppitunnin teema: Alumiini. Alumiinin sijainti jaksollisessa järjestelmässä ja sen atomin rakenne. Oleminen luonnossa. Alumiinin fysikaaliset ja kemialliset ominaisuudet.
Oppitunnin tavoitteet:
ota huomioon alumiinin jakautuminen luonnossa, sen fysikaaliset ja kemialliset ominaisuudet sekä sen muodostamien yhdisteiden ominaisuudet.
Työn eteneminen
1. Oppitunnin organisatorinen hetki. 2. Uuden materiaalin tutkimus. alumiiniPääryhmäIII jaksollisen järjestelmän ryhmät ovat boori (B), (Al) gallium (Ga), indium (In) ja tallium (Tl). Kuten yllä olevista tiedoista voidaan nähdä, kaikki nämä elementit avattiin vuonna 2006XIX luvulla.Pääryhmän metallien löytö
III
ryhmät

Boori on ei-metalli. Alumiini on siirtymämetalli, ja gallium, indium ja tallium ovat täysmetalleja. Siten, kun jaksollisen järjestelmän kunkin ryhmän elementtien atomien säteet kasvavat, yksinkertaisten aineiden metalliset ominaisuudet kasvavat.Tässä luennossa tarkastellaan lähemmin alumiinin ominaisuuksia.1. Alumiinin sijainti D. I. Mendelejevin taulukossa. Atomin rakenne, esitetty hapetusaste. Alumiinielementti sijaitseeIII ryhmä, pääasiallinen "A" -ryhmä, jaksollisen järjestelmän 3 jakso, sarjanumero 13, suhteellinen atomimassaAr (Al ) \u003d 27. Sen naapuri taulukon vasemmalla puolella on magnesiumia - tyypillistä metallia, ja oikealla puolella - piitä - jo ei-metallia. Siksi alumiinilla on oltava joitain välituoteominaisuuksia ja sen yhdisteet ovat amfoteerisia.
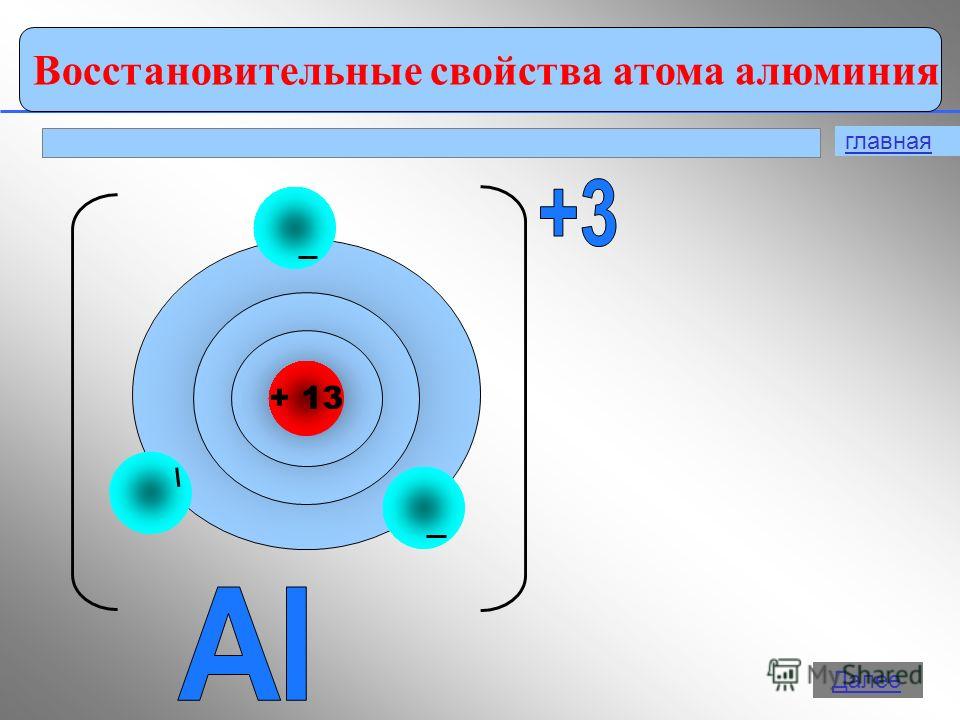
Al +13) 2) 8) 3, p on elementti,
Pohjatila
1 s 2 2 s 2 2 p 6 3 s 2 3 p 1
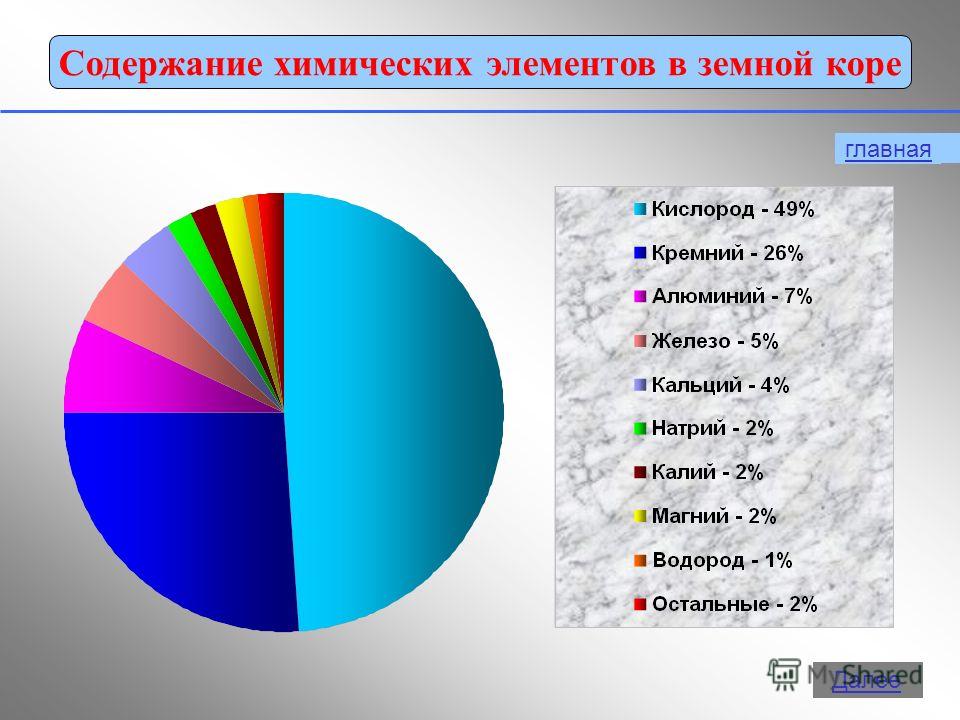
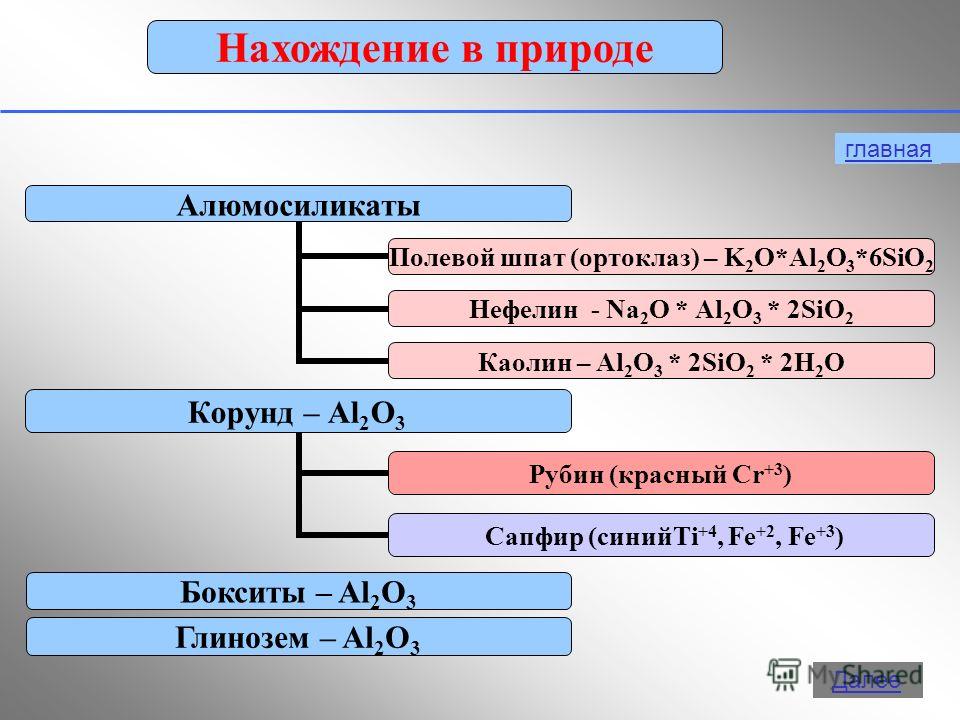
Alumiinilla on hapetustila +3 yhdisteissä:Al 0 - 3 e - → Al +3 2. Fysikaaliset ominaisuudet Vapaa alumiini on hopeanvalkoinen metalli, jolla on korkea lämmön ja sähkönjohtavuus. Sulamispiste 650 noin C. Alumiinilla on pieni tiheys (2,7 g / cm2) 3 ) on noin kolme kertaa vähemmän kuin rautaa tai kuparia, ja samalla se on vahva metalli.3. Oleminen luonnossa Levinneisyys luonnossa vie1. metallien joukossa ja 3. elementtien joukossa toinen vain happea ja piitä. Eri tutkijoiden mukaan alumiinin osuus maankuoressa on 7,45 - 8,14% maankuoren massasta.Luonnossa alumiinia esiintyy vain yhdisteissä (Minerals). Jotkut heistä: boksiitit - Al 2 O 3 H 2 O (epäpuhtauksilla SiO 2, Fe 2 O 3, CaCO 3) nefeliini - KNa 3 4 aluniitit - KAl (SO 4) 2 2Al (OH) 3 Alumiinioksidi (seos kaoliinia SiO-hiekkaan 2, kalkkikivi CaCO 3, magnesiitti MgCO 3) Korundi - Al 2 O 3 Maasälpä (ortoklaasi) - K 2 O × Al 2 O 3 × 6SiO 2 Kaoliniitti - Al 2 O 3 × 2SiO 2 × 2H 2 O · Aluniitti - (Na, K) 2SO 4 × Al 2 (SO 4) 3 × 4Al (OH) 3 Beryl - 3ВеО Al 2 О 3 6SiO 2bauksiitin
4. Alumiinin ja sen yhdisteiden kemialliset ominaisuudet Alumiini on helposti vuorovaikutuksessa hapen kanssa normaaleissa olosuhteissa ja se on päällystetty oksidikalvolla (se antaa mattapinnan).Sen paksuus on 0,00001 mm, mutta sen ansiosta alumiini ei syöpi. Alumiinin kemiallisten ominaisuuksien tutkimiseksi oksidikalvo poistetaan. (Hiekkapaperilla tai kemiallisesti: upotus ensin alkaliliuokseen oksidikalvon poistamiseksi ja sitten elohopeasuolojen liuokseen amalgaamialumiiniseoksen muodostamiseksi elohopean kanssa).minä . Yhteisvaikutukset yksinkertaisten aineiden kanssa Jo huoneenlämpötilassa alumiini reagoi aktiivisesti kaikkien halogeenien kanssa muodostaen halideja. Kuumennettuna se on vuorovaikutuksessa rikin (200 ° C), typen (800 ° C), fosforin (500 ° C) ja hiilen (2000 ° C) kanssa jodin kanssa katalyytin - veden läsnä ollessa:2A l + 3 S \u003d A l 2 S 3 (alumiinisulfidi),2Al + N2 \u003d 2AlN (alumiininitridi),A l + P \u003d A l P (alumiinifosfidi),4A1 + 3C \u003d A 1 4 C3 (alumiinikarbidia).2 Al + 3 I 2 \u003d 2 A II 3 (alumiinijodidi)Kaikki nämä yhdisteet hydrolysoidaan kokonaan alumiinihydroksidin ja vastaavasti rikkivedyn, ammoniakin, fosfiinin ja metaanin muodostamiseksi: Al 2 S 3 + 6H 2 O \u003d 2Al (OH) 3 + 3H 2 SAl 4 C 3 + 12H 2 O \u003d 4Al (OH) 3 + 3CH 4 Lastujen tai jauheen muodossa se palaa kirkkaasti ilmassa ja vapauttaa suuren määrän lämpöä:4A1 + 3 O 2 \u003d 2A I 2 O 3 + 1676 kJ.
II. Yhteisvaikutukset monimutkaisten aineiden kanssa Veden vuorovaikutus : 2 Al + 6 H20 \u003d 2 Al (OH) 3 + 3 H2 ei oksidikalvoa Yhteisvaikutukset metallioksidien kanssa: Alumiini on hyvä pelkistin, koska se on yksi aktiivisista metalleista. Se on sarjassa toimintoja heti alkalimetallimetallien jälkeen. siksipalauttaa metallit niiden oksidista . Tällaista reaktiota - aluminotermiaa - käytetään puhtaiden harvinaisten metallien, kuten esimerkiksi volframin, vanadiinin, jne. Saamiseksi.3 Fe 3 O 4 + 8 Al \u003d 4 Al 2 O 3 + 9 Fe + Q Termite seos Fe 3 O 4 ja Al (jauhe) - käytetään myös termiittihitsauksessa. С r 2 О 3 + 2А l \u003d 2С r + А l 2 О 3 Happovuorovaikutus : Rikkihappoliuoksella: 2 Al + 3 H 2SO 4 \u003d Al 2 (SO 4) 3 + 3 H2 Kylmällä väkevällä rikkihapolla ja typpi ei reagoi (passivoi). Siksi typpihappo kuljetetaan alumiinisäiliöissä. Kuumennettaessa alumiini pystyy palauttamaan nämä hapot ilman vedyn muodostumista:2А l + 6Н 2 SO 4 (conc) \u003d А l 2 (SO 4) 3 + 3 SO 2 + 6Н 2 О, А + 6Н NO 3 (conc) \u003d А l (NO 3) 3 + 3 NO 2 + 3H20. Alkali-vuorovaikutus . 2Al + 2 NaOH + 6H 2O \u003d 2 Na2Al (OH) 4 + 3H2 na[A l(OH) 4 ] – natriumtetrahydroksoaluminaatti Kemisti Gorbovin ehdotuksesta Venäjän ja Japanin sodassa tätä reaktiota käytettiin vedyn tuottamiseen ilmapalloihin. Suolaliuoksilla: 2Al + 3 CuSO 4 \u003d Al 2 (SO 4) 3 + 3 Cu Jos alumiinin pinta hierotaan elohopeaisuolalla, reaktio tapahtuu: 2 Al + 3 HgO 2 = 2 AICI 3 + 3 hgVapautunut elohopea liuottaa alumiinin muodostaen amalgaamin. 5. Alumiinin ja sen yhdisteiden käyttö

Alumiinin fysikaaliset ja kemialliset ominaisuudet ovat johtaneet sen laajaan käyttöön tekniikassa.Suurin alumiinin kuluttaja on ilmailuala. : 2/3 lentokoneesta koostuu alumiinista ja sen seoksista. Teräskone olisi liian raskas ja voisi kuljettaa paljon vähemmän matkustajia.Siksi alumiinia kutsutaan siivekäsmetalli. Kaapelit ja johdot on valmistettu alumiinista : jolla on sama sähkönjohtavuus, niiden massa on 2 kertaa pienempi kuin vastaavat kuparituotteet.Koska alumiinin korroosionkestävyys, siitätee typpihappolaitteiden ja säiliöiden osia . Alumiinijauhe on hopeamaalin valmistuksen perusta suojaamaan rautatuotteita korroosiolta ja heijastamaan lämpöä, maalia käytetään öljyvarastoissa ja palontorjuntapukuissa.Alumiinioksidilla valmistetaan alumiinia sekä tulenkestäviä materiaaleja.Alumiinihydroksidi on maaloxin, almagelin, tunnettujen lääkkeiden pääkomponentti, joka vähentää mahalaukun mehujen happamuutta. Alumiinisuolat hydrolysoituvat. Tätä ominaisuutta käytetään vedenpuhdistusprosessissa. Alumiinisulfaattia ja pieni määrä hiottua kalkkia johdetaan puhdistettuun veteen muodostuneen hapon neutraloimiseksi. Seurauksena on, että alumiinihydroksidista vapautuu irtotavaraosa, joka laskeutuessaan kantaa mukana suspendoituneita sameuden hiukkasia ja bakteereja.Siten alumiinisulfaatti on koagulantti.6. Alumiinin tuotanto 1) American Hall ja ranskalainen Eru keksivät nykyaikaisen, kustannustehokkaan alumiinin valmistusmenetelmän vuonna 1886. Se koostuu alumiinioksidiliuoksen elektrolyysistä sulassa kryoliitissa. Sulan kryoliitti Na 3 AlF6 liuottaa AI203: n, kuinka vesi liuottaa sokerin. Alumiinioksidin ”liuoksen” elektrolyysi sulassa kryoliitissa tapahtuu ikään kuin kryoliitti olisi vain liuotin ja alumiinioksidi olisi elektrolyytti.2Al 2 O 3 sähkövirta → 4Al + 3O 2 Englantilaisessa poikien ja tyttöjen tietosanakirjassa alumiinia käsittelevä artikkeli alkaa seuraavilla sanoilla: ”23. helmikuuta 1886 sivilisaation historiassa alkoi uusi metallikausi - alumiinin aika. Sinä päivänä 22-vuotias kemisti Charles Hall tuli ensimmäisen opettajansa laboratorioon kymmenellä pienellä hopeanvalkoisesta alumiinista valmistetulla pallolla kädessään ja uutisten kanssa, että hän oli löytänyt tavan valmistaa tämä metalli edullisesti ja suurina määrinä. " Joten Hallista tuli amerikkalaisen alumiiniteollisuuden perustaja ja anglosaksinen kansallinen sankari mieheksi, joka teki tieteestä hienoa liiketoimintaa. 2) 2Al 2 O 3 + 3 C \u003d 4 AI + 3 CO 2 TÄMÄ on mielenkiintoista:
- Tanskalainen fyysikko Hans Christian Oersted tunnisti alumiinimetallin ensimmäisenä vuonna 1825. Ohjaamalla kaasumainen kloori hiilen kanssa sekoitetun kuuman alumiinioksidikerroksen läpi, eristettiin eristetty alumiinikloridi ilman mitään kosteutta. Metallisen alumiinin palauttamiseksi Oersted joutui käsittelemään alumiinikloridia kaliumamalgaamilla. Kahden vuoden kuluttua saksalainen kemisti Friedrich Wöller. Hän paransi menetelmää korvaamalla kaliumamalgaamin puhtaalla kaliumilla.
18–19-vuosisatojen aikana alumiini oli tärkein korumetalli. Vuonna 1889 Lontoon D.I. Mendeleev sai arvokkaan lahjan ansioistaan \u200b\u200bkemian kehittämisessä - kullasta ja alumiinista valmistetut vaa'at.
Vuoteen 1855 mennessä ranskalainen tutkija Saint-Clair Deville kehitti menetelmän alumiinimetallin tuottamiseksi teknisessä mittakaavassa. Mutta menetelmä oli erittäin kallis. Deville nautti Ranskan keisari Napoleon III: n erityisestä suojelusta. Merkkinä omistautumisestaan \u200b\u200bja kiitollisuudestaan \u200b\u200bPaholainen teki vastasyntyneen prinssin Napoleonin pojalle tyylikkäästi kaiverretun helistin - ensimmäiset "kulutustavarat", jotka on valmistettu alumiinista. Napoleon aikoi jopa varustaa vartijansa alumiinirunkoilla, mutta hinta oli kohtuullinen. Tuolloin 1 kg alumiinia oli arvoltaan 1000 markkaa, ts. 5 kertaa kalliimpaa kuin hopea. Vasta elektrolyyttisen prosessin keksimisen jälkeen alumiinista tuli arvonsa yhtä suuri kuin tavalliset metallit.
Mutta tiesitkö, että alumiini, joutuessaan ihmiskehoon, aiheuttaa hermoston häiriöitä. Ylimääräisenä aineenvaihdunta häiriintyy. Suoja-aine on C-vitamiini, kalsiumyhdiste, sinkki.
Kun alumiini palaa happea ja fluoria, vapautuu paljon lämpöä. Siksi sitä käytetään lisäaineena rakettipolttoaineeseen. Saturnuksen raketti polttaa lennon aikana 36 tonnia alumiinijauhetta. Ajatuksen metallien käytöstä rakettipolttoaineen osana ilmaisi ensin F. A. Zander.
Think! Miksi tätä reaktiota ei voida suorittaa vesiliuoksessa? №2. Täytä kemiallinen yhtälö:
Al + H2S04 (liuos) -\u003e
Al + CuCl2 -\u003e
Al + HN03 (kons) - t -\u003e
Al + NaOH + H20 -\u003e Ei. 3. Ratkaise ongelma:
Alumiinin ja kuparin seokselle vaikutti ylimäärä väkevää natriumhydroksidiliuosta kuumennettaessa. 2,24 litraa kaasua erottui (n.o.). Laske seoksen prosentuaalinen koostumus, jos sen kokonaismassa oli 10 g?4. Kotitehtävät Huomaa: Esitystä voidaan käyttää oppitunnissa. "Alumiini. Alumiinin sijainti jaksollisessa järjestelmässä ja sen atomin rakenne. Oleminen luonnossa. Alumiinin fysikaaliset ja kemialliset ominaisuudet ".




